Нові публікації
Виявлено головний нейрон, що контролює рух у черв'яків, важливий для лікування людей
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.

Дослідники з Sinai Health та Університету Торонто виявили механізм у нервовій системі крихітного круглого черва C. elegans, який може мати значні наслідки для лікування захворювань людини та розвитку робототехніки.
Дослідження, очолюване Мей Чжен та її колегами з Науково-дослідного інституту Луненфельда-Таненбаума, опубліковане в журналі Science Advances і розкриває ключову роль специфічного нейрона під назвою AVA у контролі здатності черв'яка перемикатися між рухом вперед і назад.
Для черв'яків важливо повзати до джерел їжі та швидко відступати від небезпеки. Така поведінка, де ці дві дії взаємовиключні, типова для багатьох тварин, включаючи людей, які не можуть одночасно сидіти та бігати.
Вчені давно вважали, що контроль рухів у черв'яків здійснюється завдяки простій взаємодії двох нейронів: AVA та AVB. Вважалося, що перший сприяє руху назад, другий — руху вперед, причому кожен гальмує інший, контролюючи напрямок руху.
Однак нові дані команди Чжена спростовують цю точку зору, розкриваючи складнішу взаємодію, в якій нейрон AVA відіграє подвійну роль. Він не тільки негайно зупиняє рух вперед, пригнічуючи AVB, але й підтримує довготривалу стимуляцію AVB, щоб забезпечити плавний перехід назад до руху вперед.
Це відкриття підкреслює здатність нейрона AVA точно контролювати рух за допомогою різних механізмів залежно від різних сигналів та в різних часових масштабах.
«З інженерної точки зору, це дуже економічна конструкція», — каже Чжен, професор молекулярної генетики в Медичній школі Темерті Університету Торонто. «Сильне, стійке гальмування петлі зворотного зв’язку дозволяє тварині реагувати на несприятливі умови та втекти. Водночас керуючий нейрон продовжує постійну подачі газу в прямий цикл, щоб переміститися в безпечні місця».
Джун Менг, колишній докторант лабораторії Чжена, який керував дослідженням, сказав, що розуміння того, як тварини переходять між такими протилежними руховими станами, є ключовим для розуміння того, як тварини рухаються, а також для дослідження неврологічних розладів.
Відкриття домінуючої ролі нейрона AVA пропонує нове розуміння нейронних ланцюгів, які вчені вивчали з моменту появи сучасної генетики понад півстоліття тому. Лабораторія Чжена успішно використовувала передові технології для точної модуляції активності окремих нейронів та запису даних від живих черв'яків у русі.
Чжень, який також є професором клітинної та системної біології на факультеті мистецтв і наук Університету Торонто, наголошує на важливості міждисциплінарної співпраці в цьому дослідженні. Мен провів ключові експерименти, а електричні записи нейронів виконав Бінь Юй, аспірант лабораторії Шанбанга Гао в Хуачжунському університеті науки і технологій у Китаї.
Тосіф Ахмед, колишній постдокторант лабораторії Чжена, а нині теоретичний науковий співробітник дослідницького кампусу Джанелія HHMI у США, керував математичним моделюванням, яке було важливим для перевірки гіпотез та отримання нових знань.
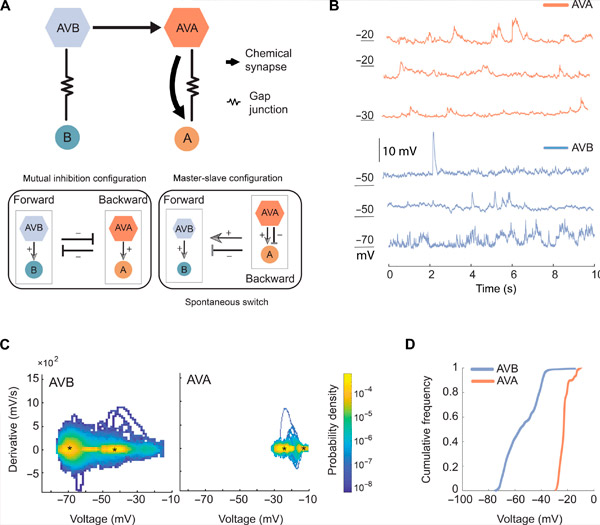
AVA та AVB мають різні діапазони та динаміку мембранного потенціалу. Джерело: Science Advances (2024). DOI: 10.1126/sciadv.adk0002
Результати дослідження пропонують спрощену модель для вивчення того, як нейрони можуть виконувати численні ролі в контролі руху – концепцію, яку також можна застосувати до неврологічних захворювань людини.
Наприклад, подвійна роль AVA залежить від його електричного потенціалу, який регулюється іонними каналами на його поверхні. Чжен вже досліджує, як подібні механізми можуть бути задіяні в рідкісному стані, відомому як синдром CLIFAHDD, спричиненому мутаціями в подібних іонних каналах. Нові результати також можуть допомогти в розробці більш адаптивних та ефективних роботизованих систем, здатних виконувати складні рухи.
«Від витоків сучасної науки до передових досліджень сьогодні, модельні організми, такі як C. elegans, відіграли важливу роль у розкритті складності наших біологічних систем», – сказала Анн-Клод Гінграс, директор Дослідницького інституту Луненфельда-Таненбаума та віце-президент з досліджень Sinai Health. «Це дослідження є чудовим прикладом того, як ми можемо вчитися у простих тварин і застосовувати ці знання для розвитку медицини та технологій».
