Нові публікації
Препарат LM11A-31 уповільнює прогресування хвороби Альцгеймера у випробуваннях
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.

У нещодавньому дослідженні, опублікованому в журналі Nature Medicine, вчені провели рандомізоване, подвійне сліпе, плацебо-контрольоване дослідження фази 2a для вивчення безпеки та ефективності препарату LM11A-31 у лікуванні хвороби Альцгеймера (ХА) шляхом модуляції рецептора нейротрофіну p75 (p75NTR).
Хвороба Альцгеймера з пізнім початком є найпоширенішою формою деменції, що характеризується синаптичною недостатністю, дегенерацією та втратою нервових клітин. Хоча два провідні препарати для лікування хвороби Альцгеймера спрямовані на накопичення аномальних білків амілоїду-β або тау-протеїну, вони впливають лише на частину патофізіології. Інший підхід включає вплив на рецептори та сигнальні мережі, які впливають на фундаментальні біологічні шляхи. Доклінічні дослідження показують, що модуляція p75NTR за допомогою нової малої хімічної молекули LM11A-31 зменшує синаптичні втрати, спричинені амілоїдом та аномальним тау-протеїном.
Опис дослідження
У цьому рандомізованому клінічному дослідженні дослідники вивчали, чи може LM11A-31 уповільнити прогресування хвороби Альцгеймера шляхом модуляції p75NTR у людей.
Учасникам дослідження протягом 26 тижнів 242 пацієнтам з легкою та середньою астмою давали пероральні капсули LM11A-31 у дозах 200 мг та 400 мг або плацебо у співвідношенні 1:1:1. Учасники мали біологічно підтверджену хворобу Альцгеймера (рівень β-білка 42 (Aβ42) у спинномозковій рідині нижче 550 нг/л або співвідношення Aβ42:β40 нижче 0,89), діагностовану за критеріями Макханна, з балами за шкалою міні-психіатричного обстеження (MMSE) від 18 до 26, балами за шкалою геріатричної депресії (GDS) нижче 5,0, балами за модифікованою шкалою ішемії Хачинського (HIS) ≤ 4,0, формальною освітою ≥ 8 років та попереднім когнітивним зниженням ≥ 6 місяців.
Учасники, що відповідали вимогам, приймали інгібітори ацетилхолінестерази (ІАХЕ) або часткові антагоністи NMDA-рецепторів протягом ≥ 3 місяців до початку дослідження. Вони не приймали заборонені препарати, такі як антипсихотичні препарати, бензодіазепіни, протиепілептичні препарати, седативні препарати, центрально активні антигіпертензивні препарати, ноотропні засоби (крім гінкго білоба) або опіоїдні анальгетики.
Первинним результатом дослідження була безпека та переносимість, оцінені за шкалою Колумбійської шкали оцінки тяжкості суїцидальних думок та поведінки (C-SSRS), життєво важливі показники, артеріальний тиск та гематологічні параметри. Для оцінки вторинних когнітивних результатів використовувалися структурна магнітно-резонансна томографія (кМРТ), фтордезоксиглюкозна позитронно-емісійна томографія (ФДГ-ПЕТ) та біомаркери спинномозкової рідини (СМР). Показники атопічного дерматиту включали Thr181-фосфорильований тау-білок, загальний тау-білок, Aβ40, Aβ42 та активність AChE. Команда використовувала індивідуальний нейропсихологічний тест для оцінки вторинних когнітивних результатів на початку дослідження, на 12-му та 26-му тижнях.
Результати дослідження
Дослідження показало, що LM11A-31 є безпечним та добре переноситься, без суттєвих проблем із безпекою. Найпоширенішими побічними явищами були головний біль, діарея, еозинофілія та назофарингіт, причому шлунково-кишкові проблеми та еозинофілія були основними причинами припинення прийому. У групі, яка приймала 400 мг, було більше випадків припинення прийому порівняно з групами, які приймали 200 мг та плацебо. МРТ не виявила жодних проблем із безпекою, включаючи аномалії, пов'язані з амілоїдом. Не було виявлено суттєвих відмінностей у когнітивних показниках або аномаліях амілоїду між двома групами лікування.
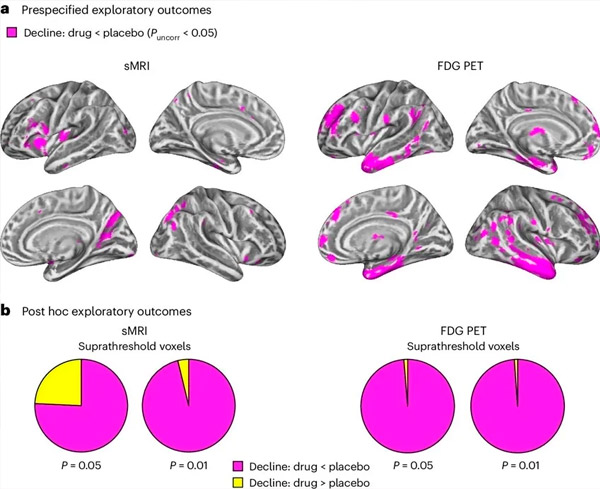
A. Двосторонній змішаний аналіз коваріації моделей досліджував взаємодію між лікуванням (ліки або плацебо) та часом (до або після лікування). Односторонній t-контраст, що досліджує гіпотезу про взаємодію (ліки уповільнюють прогресування порівняно з плацебо), показав, що лікування LM11A-31 уповільнило поздовжню дегенерацію (ліві панелі) та гіпометаболізм глюкози (праві панелі) у групі препарату (кМРТ, n = 127; ПЕТ, n = 121) порівняно з групою плацебо (кМРТ, n = 66; ПЕТ, n = 62). Вокселі, що демонструють цю взаємодію, показані при нескоригованому порозі P < 0,05 (пурпуровий) на популяційно-специфічній поверхні кори. Ліва та права півкулі показані у верхньому та нижньому рядках відповідно. Ділянки мозку, що демонструють взаємодії, що не відповідають гіпотезі, показані на рисунку 7 у додаткових даних.
B. Загальна кількість вокселів у заздалегідь визначених вразливих ділянках мозку при хворобі Альцгеймера (загальна площа кругових діаграм), що демонструють або взаємодію відповідно до гіпотези (пурпуровий колір), або взаємодію, несумісну з гіпотезою (жовтий колір), у кожному методі візуалізації (кМРТ, ліва панель; ПЕТ з ФДГ, права панель) при дедалі ліберальніших порогах нескоригованого P < 0,01 та P < 0,05. Моделювання методом Монте-Карло показало, що співвідношення вокселів, що демонструють ефекти відповідно до гіпотези, та тих, що не відповідають гіпотезі, були значно вищими, ніж ті, що спостерігалися на основі випадково згенерованих даних як для кМРТ, так і для ПЕТ (P < 0,001 для кожного методу; двосторонній тест).
LM11A-31 ефективно зменшив збільшення рівнів Aβ42 та Aβ40 у спинномозковій рідині порівняно з групою плацебо. Препарат також продемонстрував зниження медіанної річної відсоткової зміни пресинаптичного білкового біомаркера SNAP25 та зниження постсинаптичного біомаркера NG, що свідчить про уповільнення втрати пресинаптичних та постсинаптичних зв'язків. LM11A-31 також зменшив збільшення YKL40, що призвело до зниження балів за шкалою MMSE та збільшення балів за шкалою ADAS-Cog-13. Препарат також зменшив втрату сірої речовини у лобовій частці та задній тім'яній корі, а також зниження метаболізму глюкози в таких областях, як енторинальна кора, скронева кора, гіпокамп, острівцева кора та префронтальна кора.
Висновок
Дослідження показало, що модуляція p75NTR за допомогою LM11A-31 підходить для масштабніших клінічних випробувань. LM11A-31 досяг первинної кінцевої точки безпеки та добре переносився пацієнтами з легким та тяжким перебігом хвороби Альцгеймера. Результати вказують на необхідність подальших досліджень з тривалішим періодом лікування для оцінки потенціалу малих молекул для регуляції p75NTR як терапії, що модифікує перебіг хвороби, при хворобі Альцгеймера. Дослідження показало, що LM11A-31 значно впливає на кілька біомаркерів, включаючи Aβ40, Aβ42, SNAP25, NG та YKL40, що вказує на уповільнення патологічного прогресування. Майбутні дослідження можуть оцінити додаткові показники здоров'я глії.
