Нові публікації
Учені виявили новий імуносупресивний механізм при раку мозку
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Доцент, доктор філософії Філіппо Велья, та його команда з Інституту Вістар виявили ключовий механізм, за допомогою якого гліобластома – серйозний і часто смертельний рак мозку – пригнічує імунну систему, завдяки чому пухлина може рости безперешкодно для захисних сил організму.
Їхнє відкриття було опубліковано у статті «Глюкозно-керована лактиляція гістонів сприяє імуносупресивній активності макрофагів, отриманих з моноцитів, у гліобластомі» у журналі Immunity.
«Наше дослідження показує, що механізми саморозмноження раку, якщо їх достатньо зрозуміти, можна дуже ефективно використовувати проти цієї хвороби», – сказав доктор Веглія.
«Я з нетерпінням чекаю майбутніх досліджень механізмів імуносупресії, опосередкованої метаболізмом, при гліобластомі та сподіваюся, що ми продовжимо дізнаватися більше про те, як краще зрозуміти та боротися з цим раком».
Досі мало вивчено, як макрофаги та мікроглія, що походять з моноцитів, створюють імуносупресивне пухлинне мікросередовище в гліобластомі.
Лабораторія Веглія досліджувала клітинні механізми імуносупресії при гліобластомі та виявила, що в міру прогресування гліобластоми макрофаги, що походять від моноцитів, починають переважати над мікроглією, що свідчить про те, що переважання макрофагів, що походять від моноцитів, у мікросередовищі пухлини є корисним для раку з точки зору ухилення від імунної відповіді.
Дійсно, макрофаги, отримані з моноцитів, але не мікроглія, блокували активність Т-клітин (імунних клітин, що знищують пухлинні клітини) у доклінічних моделях та у пацієнтів. Команда підтвердила це, оцінивши доклінічні моделі гліобластоми зі штучно зменшеною кількістю макрофагів, отриманих з моноцитів.
Як і очікувалося, моделі з меншою кількістю злоякісних макрофагів у мікросередовищі пухлини показали кращі результати порівняно зі стандартними моделями гліобластоми.
Гліобластома становить трохи більше половини всіх злоякісних пухлин, що виникають у мозку, і прогноз для пацієнтів з діагнозом цього захворювання вкрай поганий: лише 25% пацієнтів виживають протягом першого року після встановлення діагнозу. Гліобластома небезпечна не лише через своє розташування в мозку, але й через імуносупресивне мікрооточення пухлини, яке робить гліобластому стійкою до перспективних імунотерапій.
Програмуючи певні імунні клітини, такі як макрофаги (макрофаги та мікроглія, що походять від моноцитів), працювати на пухлину, а не проти неї, гліобластома створює для себе пухлинне мікросередовище, яке дозволяє раку агресивно рости, уникаючи протипухлинних імунних відповідей.
Уточнення механізму
Підтвердивши роль макрофагів, отриманих з моноцитів, лабораторія Веглії потім спробувала зрозуміти, як саме ці пов'язані з раком імунні клітини працюють проти імунної системи.
Вони секвенували макрофаги, щоб визначити, чи мають клітини якісь аномальні патерни експресії генів, які можуть вказувати на гени, що відіграють роль в імуносупресії, а також дослідили метаболічні патерни макрофагів, щоб з'ясувати, чи пов'язана аномальна експресія генів з метаболізмом.
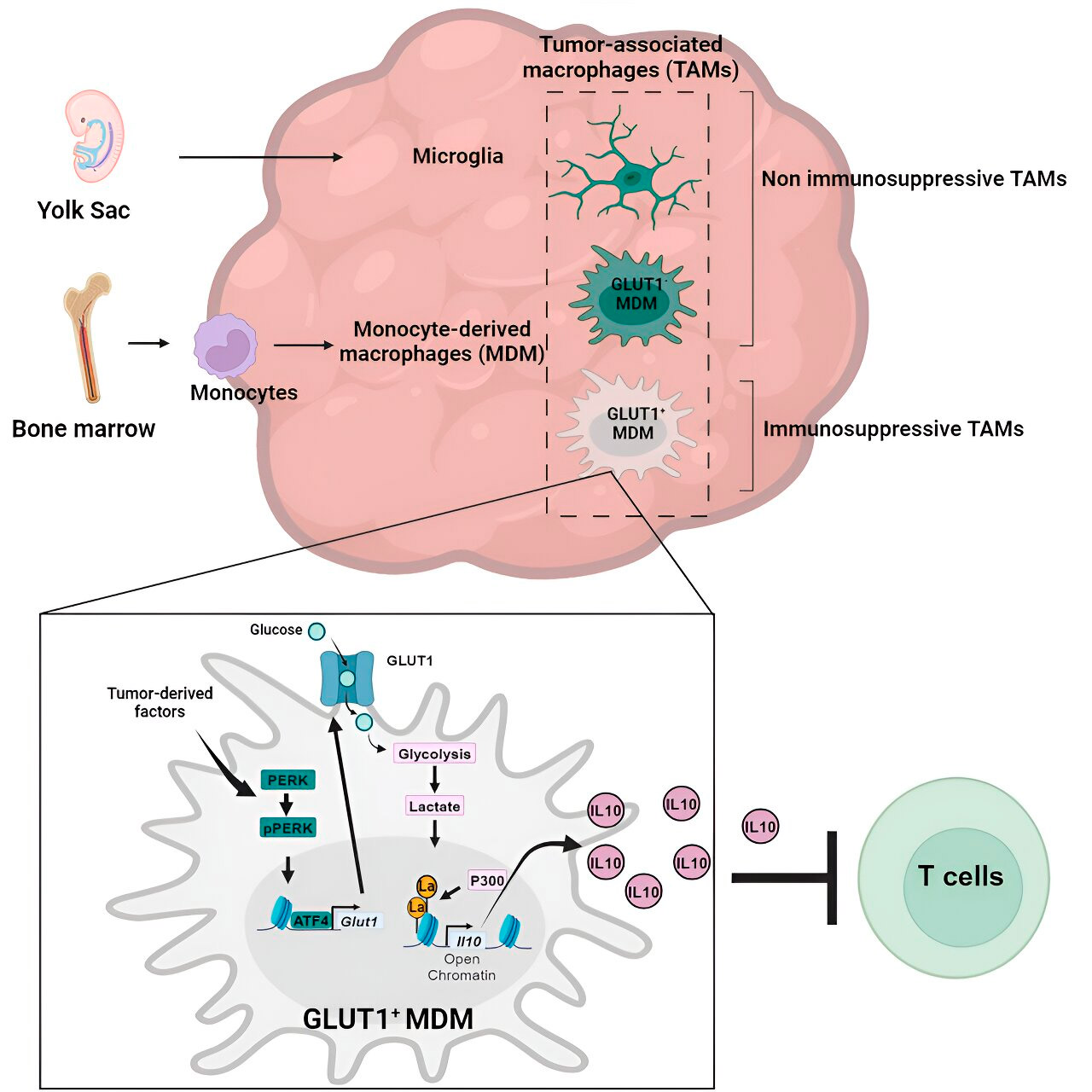
Генний та метаболічний аналіз привів їх до метаболізму глюкози. Серія тестів показала, що макрофаги, отримані з моноцитів, з підвищеним метаболізмом глюкози та експресією GLUT1, основного транспортера глюкози, блокували функцію Т-клітин, вивільняючи інтерлейкін-10 (IL-10).
Команда дослідників продемонструвала, що гліобластома порушує метаболізм глюкози в цих макрофагах, що спричиняє їхню імуносупресивну активність.
Лактилювання гістонів та його роль
Дослідники виявили, що ключем до імуносупресивної активності макрофагів, отриманих з моноцитів, пов'язаної з метаболізмом глюкози, є процес, який називається «лактилювання гістонів». Гістони – це структурні білки в геномі, які відіграють ключову роль в експресії таких генів, як IL-10, у певних контекстах.
Швидко метаболізуючи глюкозу, макрофаги, що походять з моноцитів, виробляють лактат, побічний продукт метаболізму глюкози. Гістони можуть «лактилюватися» (тобто лактат інтегрується в гістони) таким чином, що організація гістонів сприяє експресії IL-10, який виробляється макрофагами, що походять з моноцитів, для підтримки росту ракових клітин.
Рішення проблеми
Але як можна зупинити імуносупресивну активність макрофагів, отриманих з моноцитів, пов'язану з метаболізмом глюкози? Доктор Велья та його команда визначили можливе рішення: PERK, фермент, який вони ідентифікували як регулятор метаболізму глюкози та експресії GLUT1 у макрофагах.
У доклінічних моделях гліобластоми, вплив на PERK порушував лактилювання гістонів та імуносупресивну активність макрофагів, а в поєднанні з імунотерапією блокував прогресування гліобластоми та індукував довготривалий імунітет, який захищав мозок від повторного росту пухлини, що свідчить про те, що вплив на вісь PERK-лактилювання гістонів може бути життєздатною стратегією боротьби з цим смертельним раком мозку.
