Нові публікації
Похідні сполуки талідоміду призводять до загибелі стійких ракових клітин
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Дослідження, проведене Університетом Гете у Франкфурті, вказує на можливість використання похідних талідоміду для лікування раку. Талідомід продавався як снодійне у 1950-х роках. Пізніше він став сумнозвісним тим, що спричиняв важкі вроджені вади на ранніх стадіях вагітності.
Також відомо, що ця молекула маркує білки в клітині для знищення. В рамках поточного дослідження вчені створили похідні талідоміду. Вони змогли показати, що ці речовини впливають на руйнування білків, відповідальних за виживання ракових клітин.
Мабуть, жодна інша молекула не мала такого бурхливого минулого, як талідомід. Він був основним інгредієнтом препарату, схваленого в багатьох країнах у 1950-х роках як заспокійливий та снодійний засіб. Але незабаром стало зрозуміло, що вагітні жінки, які приймали талідомід, часто народжували дітей із серйозними каліцтвами.
Однак в останні десятиліття медицина знову покладає на нього великі надії. Дослідження показали, серед іншого, що він пригнічує ріст кровоносних судин і тому потенційно придатний для відсікання пухлин від їхнього живильного середовища. Потім він також виявився дуже ефективним у лікуванні множинної мієломи, злоякісних пухлин у кістковому мозку.
«Тепер ми знаємо, що талідомід можна назвати «молекулярним клеєм», — пояснює доктор Сінлай Ченг з Інституту фармацевтичної хімії Університету Гете у Франкфурті. — Це означає, що він здатний захоплювати два білки та з’єднувати їх разом».
Це особливо цікаво, оскільки один із цих білків є своєрідною «машиною для маркування»: він прикріплює однозначну мітку «СМІТТЯ» до іншого білка.
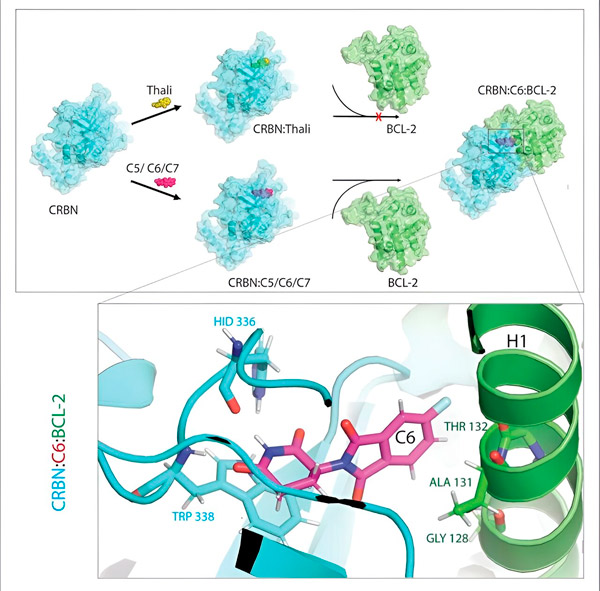
Похідні талідоміду C5, C6 та C7 змінюють CRBN, «машину для маркування», щоб вона могла зв'язуватися з BCL-2. Таким чином, молекула BCL-2 маркується для деградації — можлива нова стратегія боротьби з раком. Автор: доктор Сінлай Ченг.
Система утилізації відходів клітини розпізнає цю мітку: вона захоплює мічену молекулу білка та подрібнює її. «Цей механізм пояснює різні ефекти талідоміду», — каже Ченг. «Залежно від того, який білок мічений, він може спричиняти деформації під час ембріонального розвитку або знищувати злоякісні клітини».
Цей механізм відкриває великі можливості для медицини, оскільки ракові клітини залежать від певних білків для виживання. Якби їх можна було систематично впливати та подрібнювати, можливо, хворобу можна було б вилікувати. Проблема полягає в тому, що молекулярний клей досить своєрідний.
Одним із партнерів по зв'язуванню завжди є мічальна машина клітини, або, науковою мовою, E3-лігаза під назвою CRBN. Лише дуже небагато з багатьох тисяч білків в організмі можуть бути другим партнером — які саме, залежить від клею.
«Тож ми створили серію похідних талідоміду», — каже Ченг. «Потім ми перевірили, чи мають вони адгезивні властивості, і якщо так, то проти яких білків вони ефективні». Для цього дослідники додали свої похідні до всіх білків у культивованій клітинній лінії. Потім вони спостерігали, які з цих білків потім деградували у присутності CRBN.
«У процесі ми визначили три похідні, які могли б мітити клітинний білок, дуже важливий для деградації, BCL-2», – пояснює Ченг. «BCL-2 запобігає активації клітинами своєї програми самознищення, тому, якщо його немає, клітини гинуть».
Ось чому BCL-2 вже давно є предметом досліджень раку. Існує навіть препарат від лейкемії під назвою венетоклакс, який знижує ефективність BCL-2 і таким чином призводить до самознищення мутованих клітин.
«Однак у багатьох ракових клітинах сам BCL-2 мутований. В результаті венетоклакс більше не пригнічує білок», — каже Ченг. «Ми змогли показати, що наші похідні також позначають цю мутовану форму для деградації. Крім того, наші партнери з Інституту біофізики імені Макса Планка змоделювали взаємодію похідних талідоміду з BCL-2 на комп’ютері. Це показало, що похідні зв’язуються з зовсім іншими ділянками, ніж венетоклакс — результат, який ми пізніше змогли підтвердити експериментально».
Дослідники також випробували свої сполуки на плодових мушках з раковими клітинами. Виживання мух, оброблених таким чином, було значно вищим. Однак Ченг застерігає від надмірних надій, оскільки ці результати все ще є фундаментальним дослідженням. «Хоча вони показують, що модифіковані молекули талідоміду мають великий терапевтичний потенціал, ми поки що не можемо сказати, чи виправдають вони себе на практиці в певний момент часу».
Результати дослідження були опубліковані в журналі Cell Reports Physical Science.
