Дослідження підкреслює потребу в клітинно-типоспецифічних методах лікування ВІЛ
Останній перегляд: 14.06.2024

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Дослідники з Університету Іллінойсу продемонстрували важливість націлювання на конкретні типи клітин у лікуванні ВІЛ. Їхнє дослідження, опубліковане в Proceedings of the National Academy of Sciences, є одним із перших, у якому вивчаються диференціальні або типоспецифічні ефекти модуляції латентності ВІЛ на мієлоїдні клітини.. Клітини, тип імунних клітин, що виробляються в кістковому мозку.
Однією з головних перешкод для усунення ВІЛ-інфекції є контроль затримки, або періоду, протягом якого інфікована клітина перебуває в стані спокою і не може виробляти вірус. Приховані клітини ВІЛ накопичуються в організмі в місцях, відомих як резервуари. Латентні резервуари є проблематичними, оскільки вони можуть почати виробляти вірус у будь-який момент.
Повна ліквідація захворювання вимагатиме видалення всіх прихованих клітин з організму або постійного опору стимулам активації. Однак реактивація може бути спричинена різними факторами, зокрема сигналами, які спрямовують диференціювання мієлоїдних клітин.
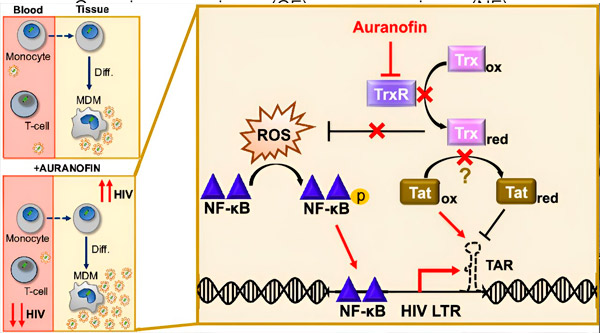
Регуляція затримки ВІЛ у моноцитарних макрофагах (MDM) може становити ризик поширення вірусу. Диференціація моноцитів у макрофаги може спричинити реактивацію ВІЛ, потенційно сприяючи поширенню вірусу в тканинах (угорі ліворуч). Клінічний кандидат, Ауранофін, зменшує кількість вірусної ДНК у крові та сприяє затримці ВІЛ у Т-клітинах і моноцитах, але викликає реактивацію ВІЛ у МДМ (внизу ліворуч). У MDM ми припускаємо, що інгібування TrxR ауранофіном призводить до накопичення активних форм кисню (АФК), що викликає активацію NF-κB та активацію промотора LTR ВІЛ (праворуч). Інгібування TrxR потенційно зменшує відновлення субстрату, дозволяючи білку Tat залишатися переважно окисленим, де він може зв’язуватися з TAR та ініціювати транскрипцію ВІЛ. Джерело: Праці Національної академії наук (2024). DOI: 10.1073/pnas.2313823121
Протягом багатьох років дослідження ліків від ВІЛ зосереджувалися навколо двох підходів, відомих як «шок і вбий» і «блок і блок». Перший діє в поєднанні з антиретровірусною терапією, щоб активувати латентно інфіковані клітини та знищувати їх через апоптоз або запрограмовану клітинну смерть, тоді як останній змушує інфіковані клітини перейти в глибокий латентний стан, після якого вони не можуть реактивуватися самостійно.
Дослідження цих методів традиційно зосереджувалися на типі лейкоцитів, які називаються Т-клітинами, які є головною мішенню ВІЛ-інфекції. Однак латентні резервуари складаються не тільки з Т-клітин; фактично вони містять десятки різних типів клітин, кожна зі своїми унікальними моделями експресії гена ВІЛ.
«Існує величезна різноманітність клітин, навіть в межах однієї лінії», — сказав Коллін Кіффер, доцент кафедри мікробіології та автор статті. «Змінність реакції в цих резервуарах зростає з кожним новим типом клітин».
Александра Бланко, аспірантка лабораторії Кіффера, хотіла вивчити типи клітин, які були пропущені в традиційних дослідженнях ВІЛ. Зосередившись на мієлоїдних клітинах, вона створила бібліотеку клонів, що містить 70 популяцій латентно інфікованих моноцитів. Потім Бланко проаналізував клональні популяції та їхні реакції на активацію. Відповіді значно відрізнялися, підкреслюючи велику різноманітність в межах одного типу клітин.
Це спостереження породжує нове запитання: чи справді різні типи клітин по-різному реагують на латентне лікування ВІЛ? Дійсно, результати їхнього дослідження показали, що деякі засоби лікування латентності проти ВІЛ можуть сприяти латентності в Т-клітинах і моноцитах, тоді як у макрофагах вони можуть змінювати латентність.
«Не всі клітини в організмі однакові», — сказав Кіффер. «Тож має сенс, що не всі інфіковані клітини однаково реагуватимуть на вірус».
У їхній статті підкреслюється необхідність у майбутніх методах лікування ВІЛ враховувати всі типи клітин і те, як кожна клітина може реагувати на потенційну терапію.
Їхні висновки ґрунтуються на дослідженнях Роя Дара, колишнього професора біоінженерії зі штату Іллінойс, чия лабораторія вивчала неоднорідність експресії генів ВІЛ.
«Він це почав, а ми взяли на себе й довели туди, де воно зараз», — сказав Кіффер. «Тож співпраця дійсно дала початок цим результатам. Це перетворилося на новий напрямок для нашої лабораторії, і ми дуже раді цьому».
Додатковий і несподіваний висновок аналізу Бланко виявив зміни розміру та форми клітин у відповідь на інфекцію, що свідчить про те, що ВІЛ може змінити морфологію клітин. Наступна мета Бланко — визначити біологічні механізми, що лежать в основі цих фенотипових змін.
Кіффер і члени його лабораторії також з нетерпінням чекають повторення своїх результатів, які були здебільшого зроблені на лінії клітин, у первинних клітинах. Відтворення результатів у більш схожій на людину моделі підвищить клінічну значущість дослідження, пояснив Кіффер.
«Ми хотіли б провести більші аналізи Т-клітин, моноцитів і макрофагів, щоб ідентифікувати потенційні ліки, які могли б працювати на всіх цих типах клітин», — сказав Бланко. «Ми могли б знайти ще більше молекул, які не поводяться відповідно до типу клітини».
