Нові генетичні механізми можуть забезпечити терапевтичні мішені проти гліоми
Останній перегляд: 14.06.2024

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Дослідження в лабораторії Ши-Юань Ченга, доктора філософії, професора відділу нейроонкології Кена і Рут Дейві на кафедрі неврології, виявили нові механізми, що лежать в основі альтернативних подій сплайсингу РНК у клітинах пухлини гліоми, які можуть служити нові терапевтичні цілі. Результати дослідження опубліковані в Journal of Clinical Investigation.
"Ми знайшли інший спосіб лікування гліоми через призму альтернативного сплайсингу та виявили нові мішені, які раніше не були ідентифіковані, але важливі для злоякісності гліоми", сказав Сяо Сонг, доктор медичних наук, доцент кафедри неврології та провідний автор дослідження.
Гліоми є найпоширенішим типом первинної пухлини головного мозку у дорослих і походять із гліальних клітин, які знаходяться в центральній нервовій системі та підтримують найближчі нейрони. Через генетичну та епігенетичну гетерогенність пухлини гліоми дуже стійкі до стандартних методів лікування, включаючи радіацію та хіміотерапію, що підкреслює необхідність пошуку нових терапевтичних цілей.
Попередні дослідження лабораторії Cheng, опубліковані в Cancer Research, показали, що важливий фактор сплайсингу SRSF3 значно підвищений у гліомах порівняно з нормальним мозком, і SRSF3 регулюється Сплайсинг РНК сприяє росту та прогресуванню гліоми, впливаючи на численні клітинні процеси в пухлинних клітинах.
Сплайсинг РНК – це процес, який передбачає видалення інтронів (некодуючих ділянок РНК) і з’єднання екзонів (кодуючих ділянок) для утворення зрілої молекули мРНК, яка підтримує експресію генів у клітині.
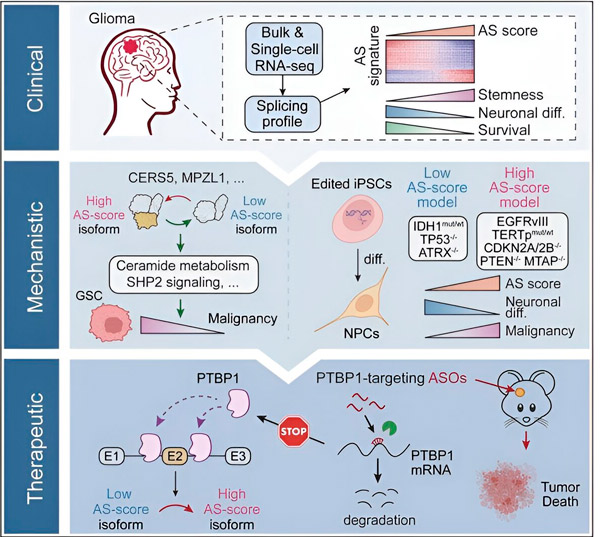
У цьому дослідженні вчені мали намір визначити зміни в альтернативному сплайсингу в клітинах пухлини гліоми, механізми, що лежать в основі цих змін, і визначити їх потенціал як терапевтичних мішеней.
Використовуючи обчислювальні методи та технології секвенування РНК, дослідники досліджували зміни сплайсингу в клітинах пухлини гліоми зі зразків пацієнтів. Щоб підтвердити ці зміни, вони використали технології редагування генів CRISPR, щоб ввести різні мутації драйвера гліоми в моделі гліоми, отримані з індукованих плюрипотентних стовбурових клітин людини (iPSC).
Вони виявили, що ці зміни сплайсингу посилюються варіантом рецептора епідермального фактора росту III (EGFRIII), який, як відомо, надмірно експресується в багатьох пухлинах, включаючи гліоми, і пригнічується мутацією в гені IDH1. p>
Дослідники підтвердили функцію двох подій сплайсингу РНК, які створюють різні ізоформи білка з різними амінокислотними послідовностями.
«Лише одна з цих ізоформ може сприяти росту пухлини, на відміну від іншої ізоформи, яка зазвичай експресується в нормальному мозку. Пухлини використовують цей механізм для вибіркової експресії ізоформи, що сприяє розвитку пухлини, порівняно із ізоформою нормального мозку», — Сонг. Сказав.
Далі команда проаналізувала білки, що зв’язують РНК, і виявила, що ген PTBP1 регулює сплайсинг РНК, що сприяє пухлинам, у клітинах гліоми. Використовуючи модель гліоми миші з ортотопічним імунодефіцитом, дослідники націлили на PTBP1 терапію антисмисловими олігонуклеотидами (ASO), яка остаточно придушила ріст пухлини.
«Наші дані підкреслюють роль альтернативного сплайсингу РНК у впливі на злоякісність і гетерогенність гліоми та його потенціал як терапевтичної вразливості для лікування дорослих гліом», — пишуть автори дослідження.
Далі дослідники планують вивчити потенціал націлювання на PTBP1 для індукції протипухлинної імунної відповіді, сказав Сонг.
"Використовуючи довгозчитуваний RNA-seq аналіз, ми виявили, що націлювання на PTBP1 у клітинах гліоми призводить до виробництва багатьох альтернативно сплайсованих транскриптів, які відсутні в нормальних тканинах. Тому наш наступний проект — з’ясувати, чи може ця ізоформа генерувати деякі антигени». Щоб імунна система могла краще розпізнавати пухлину», – сказав Сонг.
Сонг також додала, що її команда зацікавлена в аналізі змін сплайсингу в непухлинних клітинах пацієнтів з гліомою, таких як імунні клітини.
Ми вже знаємо, що сплайсинг дуже важливий для регуляції функції клітини, тому він має регулювати не лише злоякісність пухлини, але також може регулювати функцію імунних клітин, щоб визначити, чи можуть вони ефективно вбивати рак. Тож ми також проведення деяких біоінформаційних аналізів в інфільтрованих пухлиною імунних клітинах, щоб з’ясувати, чи є зміни в сплайсингу після того, як імунна клітина проникла в пухлину.
«Наша мета — визначити роль альтернативного сплайсингу у формуванні мікрооточення пухлини, що пригнічує імунітет, і визначити потенційні мішені для підвищення ефективності імунотерапії гліоми», — сказав Сонг.
