Вчені виявили новий імуносупресивний механізм при раку мозку
Останній перегляд: 14.06.2024

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Доцент Філіппо Велья, доктор філософії, та його команда з Інституту Вістар виявили ключовий механізм розвитку гліобластоми — серйозного та часто смертельного раку мозку — пригнічує імунну систему, щоб пухлина могла рости, не зустрічаючи опору з боку захисних механізмів організму.
Їхнє відкриття було опубліковано в статті «Лактилювання гістонів, кероване глюкозою, сприяє імуносупресивній активності моноцитарних макрофагів у гліобластомі» в Immunity.
«Наше дослідження показує, що механізми самозбереження раку, якщо їх достатньо зрозуміти, можна дуже ефективно використовувати проти хвороби», — сказав доктор Велья.
"Я з нетерпінням чекаю майбутніх досліджень механізмів метаболічної імуносупресії при гліобластомі та сподіваюся, що ми продовжимо дізнаватися більше про те, як краще розуміти цей рак і боротися з ним".
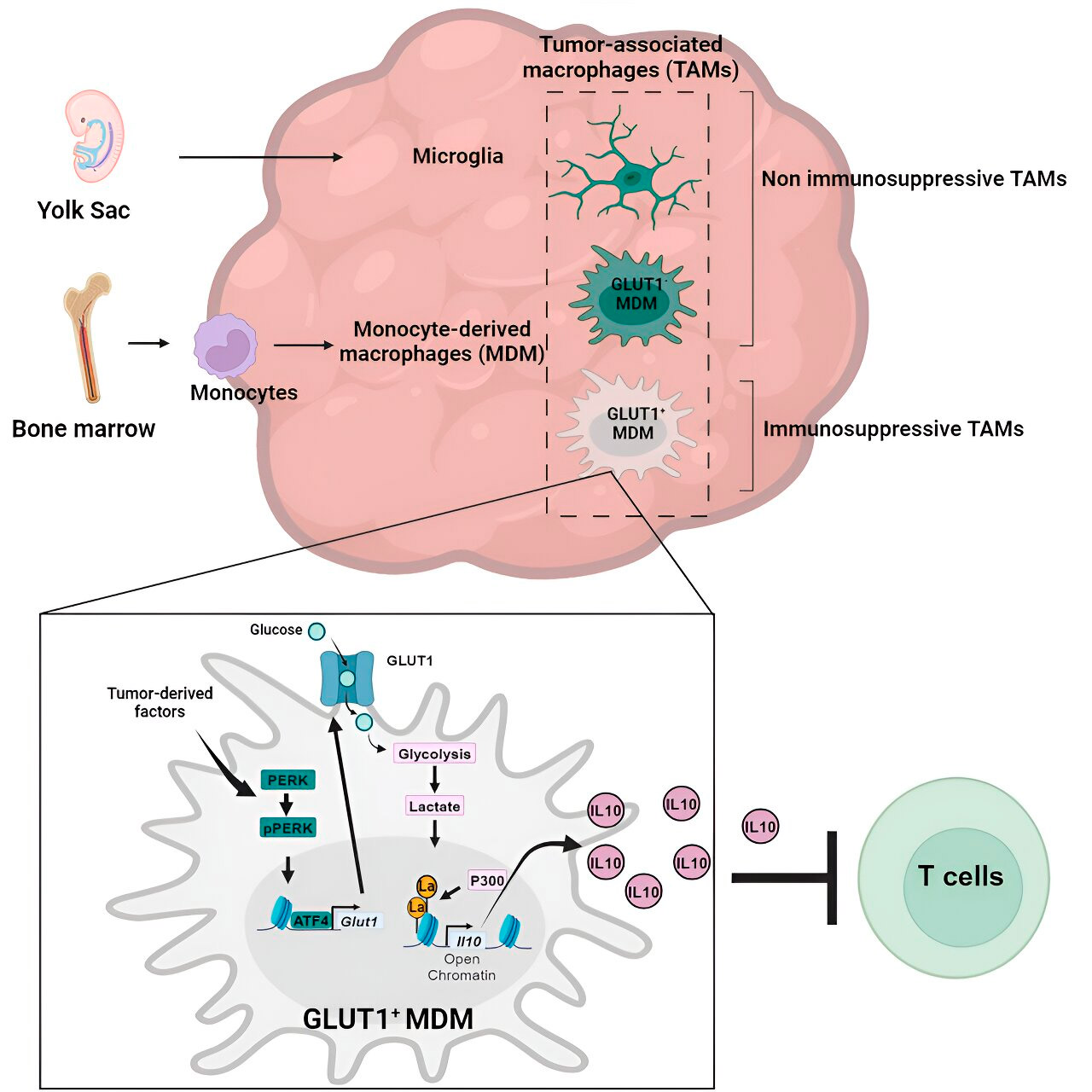
Досі мало вивчено те, як моноцитарні макрофаги та мікроглія створюють імуносупресивне пухлинне мікрооточення в гліобластомі.
Лабораторія Weglia досліджувала клітинні механізми імуносупресії в гліобластомі та виявила, що в міру прогресування гліобластоми кількість макрофагів моноцитарного походження починає перевищувати кількість мікроглії, що вказує на те, що переважання макрофагів моноцитарного походження в мікрооточенні пухлини є корисним для раку з точки зору ухилення від імунної відповіді.
Дійсно, моноцитарні макрофаги, але не мікроглія, блокували активність Т-клітин (імунних клітин, які знищують пухлинні клітини) у доклінічних моделях і у пацієнтів. Команда підтвердила це, оцінивши доклінічні моделі гліобластоми зі штучно зменшеною кількістю моноцитарних макрофагів.
Як і очікувалося, моделі з меншою кількістю злоякісних макрофагів у мікрооточенні пухлини показали кращі результати порівняно зі стандартними моделями гліобластоми.
Гліобластома становить трохи більше половини всіх злоякісних пухлин, що виникають у головному мозку, і прогноз для пацієнтів, у яких діагностовано це захворювання, надзвичайно поганий: лише 25% пацієнтів виживають протягом першого року після встановлення діагнозу. Гліобластома небезпечна не лише через своє розташування в мозку, але й через імуносупресивне мікрооточення пухлини, яке робить гліобластому стійкою до багатообіцяючих імунотерапій.
Програмуючи певні імунні клітини, такі як макрофаги (моноцитарні макрофаги та мікроглія), працювати на пухлину, а не проти неї, гліобластома створює для себе пухлинне мікрооточення, яке дозволяє раку агресивно рости, уникаючи протиракової дії імунні реакції.
З'ясування механізму
Підтвердивши роль макрофагів моноцитного походження, лабораторія Weglia спробувала зрозуміти, як саме ці імунні клітини, пов’язані з раком, діють проти імунної системи.
Вони секвенували макрофаги, щоб визначити, чи є в клітинах будь-які аномальні моделі експресії генів, які могли б вказувати на гени, які відіграють роль у імуносупресії, а також досліджували метаболічні моделі макрофагів, щоб зрозуміти, чи аномальна експресія генів пов’язана з метаболізмом.
Аналіз генів і метаболізму привів їх до метаболізму глюкози. Серія тестів показала, що моноцитарні макрофаги з підвищеним метаболізмом глюкози та експресією GLUT1, основного транспортера глюкози, блокують функцію Т-клітин, вивільняючи інтерлейкін-10 (IL-10).
Команда показала, що гліобластома порушує метаболізм глюкози в цих макрофагах, спричиняючи їхню імуносупресивну дію.
Лактилювання гістонів та його роль
Дослідники виявили, що ключ до імуносупресивної активності моноцитарних макрофагів, пов’язаних з метаболізмом глюкози, лежить у процесі, який називається «лактиляція гістонів». Гістони — це структурні білки в геномі, які відіграють ключову роль у експресії генів, таких як IL-10, у певних контекстах.
Шляхом швидкого метаболізму глюкози макрофаги, що походять із моноцитів, виробляють лактат, побічний продукт метаболізму глюкози. Гістони можуть стати «лактильованими» (тобто лактат інтегрується в гістони), так що організація гістонів сприяє експресії IL-10, який виробляється моноцитарними макрофагами для підтримки росту ракових клітин.
Рішення проблеми
Але як можна зупинити імуносупресивну активність моноцитарних макрофагів, пов’язану з метаболізмом глюкози? Доктор Вегліа та його команда знайшли можливе рішення: PERK, фермент, який вони визначили як регулятор метаболізму глюкози та експресії GLUT1 у макрофагах.
У доклінічних моделях гліобластоми націлювання на PERK порушувало лактиляцію гістонів та імуносупресивну активність макрофагів, а в поєднанні з імунотерапією блокувало прогресування гліобластоми та індукувало тривалий імунітет, який захищав мозок від повторного росту пухлини, що свідчить про те, що націлювання на PERK-гістони вісь лактиляції може бути життєздатною стратегією боротьби з цим смертоносним раком мозку.
