Нові публікації
Дослідження підкреслює необхідність терапії, специфічної для кожного типу клітин, при ВІЛ
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Дослідники з Університету Іллінойсу продемонстрували важливість впливу на певні типи клітин у лікуванні ВІЛ. Їхнє дослідження, опубліковане в журналі Proceedings of the National Academy of Sciences, є одним з перших, яке розглядає диференціальний або специфічний для типу клітин вплив модуляції латентності ВІЛ на мієлоїдні клітини – тип імунних клітин, що виробляються в кістковому мозку.
Однією з головних перешкод на шляху до ліквідації ВІЛ-інфекції є управління латентністю, або періодом, протягом якого інфікована клітина перебуває в стані спокою та не може виробляти вірус. Латентні клітини ВІЛ накопичуються в організмі в місцях, відомих як резервуари. Латентні резервуари є проблематичними, оскільки вони можуть почати виробляти вірус у будь-який час.
Повне викорінення захворювання вимагатиме видалення всіх латентних клітин з організму або постійної стійкості до стимулів активації. Однак реактивація може бути спровокована різними факторами, включаючи сигнали, що спрямовують диференціацію мієлоїдних клітин.
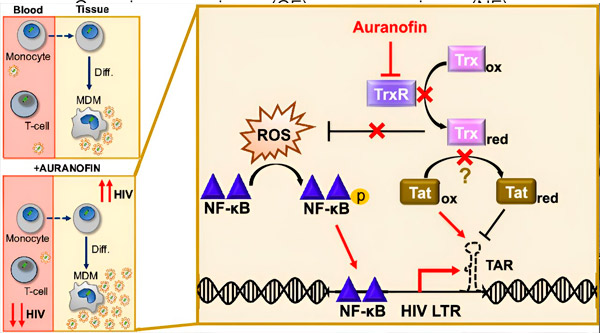
Регуляція латентності ВІЛ у макрофагах, отриманих з моноцитів (MDM), може становити ризик для поширення вірусу. Диференціація моноцитів у макрофаги може спровокувати реактивацію ВІЛ, потенційно сприяючи поширенню вірусу в тканинах (угорі ліворуч). Клінічний кандидат, Ауранофін, зменшує вірусну ДНК у крові та сприяє латентності ВІЛ у Т-клітинах та моноцитах, але викликає реактивацію ВІЛ у MDM (внизу ліворуч). У MDM ми висуваємо гіпотезу, що інгібування TrxR Ауранофіном призводить до накопичення активних форм кисню (ROS), що індукує активацію NF-κB та активацію промотора LTR ВІЛ (праворуч). Інгібування TrxR потенційно зменшує відновлення субстрату, дозволяючи білку Tat залишатися переважно окисленим, де він може зв'язуватися з TAR та ініціювати транскрипцію ВІЛ. Джерело: Праці Національної академії наук (2024). DOI: 10.1073/pnas.2313823121
Роками дослідження лікування ВІЛ зосереджувалися навколо двох підходів, відомих як «шок і знищення» та «блокування і блокування». Перший працює в поєднанні з антиретровірусною терапією для активації латентно інфікованих клітин і знищення їх шляхом апоптозу, або запрограмованої клітинної смерті, тоді як другий змушує інфіковані клітини переходити в глибокий латентний стан, з якого вони не можуть реактивуватися самостійно.
Дослідження цих методів традиційно зосереджувалися на типі лейкоцитів, які називаються Т-клітинами, що є основною мішенню ВІЛ-інфекції. Однак латентні резервуари складаються не лише з Т-клітин; насправді вони містять десятки різних типів клітин, кожен з яких має свої унікальні патерни експресії генів ВІЛ.
«Існує величезна різноманітність клітин, навіть в межах однієї лінії», — сказав Коллін Кіффер, доцент кафедри мікробіології та автор статті. «Мінливість реакції в цих резервуарах збільшується з кожним новим типом клітин».
Александра Бланко, аспірантка лабораторії Кіффера, хотіла вивчити типи клітин, які були пропущені в традиційних дослідженнях ВІЛ. Зосередившись на мієлоїдних клітинах, вона створила бібліотеку клонів, що містила 70 популяцій латентно інфікованих моноцитів. Потім Бланко проаналізувала клональні популяції та їх реакції на активацію. Реакції сильно відрізнялися, що підкреслювало велику різноманітність в межах одного типу клітин.
Це спостереження викликало нове питання: чи справді різні типи клітин по-різному реагують на лікування латентного періоду ВІЛ? Дійсно, їхні результати показали, що деякі методи лікування латентного періоду ВІЛ можуть сприяти латентності Т-клітин і моноцитів, водночас вони можуть звертати латентність у макрофагах.
«Не всі клітини в організмі однакові», — сказав Кіффер. «Тому логічно, що не всі інфіковані клітини реагуватимуть на вірус однаково».
У своїй статті вони підкреслюють необхідність врахування всіх типів клітин та того, як кожна клітина може реагувати на потенційні методи лікування в майбутньому.
Їхні висновки ґрунтуються на дослідженні Роя Дара, колишнього професора біоінженерії з Іллінойсу, чия лабораторія вивчала гетерогенність експресії генів ВІЛ.
«Він розпочав, а ми взялися за справу та довели її до того стану, до якого вона має сьогодні», – сказав Кіффер. «Тож ця співпраця справді дала старт цим результатам. Вона перетворилася на новий напрямок для нашої лабораторії, і ми дуже цим раді».
Додаткове та неочікуване відкриття з аналізу Бланко виявило зміни розміру та форми клітин у відповідь на інфекцію, що свідчить про те, що ВІЛ може змінювати морфологію клітин. Наступна мета Бланко — визначити біологічні механізми, що лежать в основі цих фенотипових змін.
Кіффер та члени його лабораторії також з нетерпінням чекають можливості відтворити свої результати, які здебільшого були отримані на клітинній лінії, на первинних клітинах. Відтворення результатів на моделі, більш схожій на людину, покращило б клінічну значущість дослідження, пояснив Кіффер.
«Ми хотіли б провести масштабніші скринінгові дослідження Т-клітин, моноцитів та макрофагів, щоб визначити потенційні препарати, які могли б діяти на всі ці типи клітин», – сказав Бланко. «Ми можемо знайти ще більше молекул, які не поводяться специфічним для певного типу клітин способом».
