Нові публікації
Мутація гена ARID1A робить пухлини чутливими до імунотерапії
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Імунотерапія здійснила революцію в лікуванні раку за останні роки. Замість безпосереднього впливу на пухлини, імунотерапія спрямовує імунну систему пацієнтів на ефективнішу атаку пухлин. Це особливо ефективно для деяких видів раку, які важко лікувати. Однак менше половини всіх онкохворих реагують на сучасну імунотерапію, що створює нагальну потребу у визначенні біомаркерів, які можуть передбачити, які пацієнти найімовірніше отримають користь від лікування.
Нещодавно вчені помітили, що пацієнти, пухлини яких мають мутацію в гені ARID1A, частіше позитивно реагують на блокаду імунних контрольних точок – тип імунотерапії, який працює шляхом підтримки активації імунних клітин, що борються з раком.
Оскільки мутація гена ARID1A присутня в багатьох видах раку, включаючи рак ендометрія, яєчників, колоректального раку, шлунка, печінки та підшлункової залози, дослідники Інституту Солка задавалися питанням, як вона може впливати на чутливість лікування та як клініцисти можуть використовувати цю інформацію для персоналізації лікування раку для кожного пацієнта.
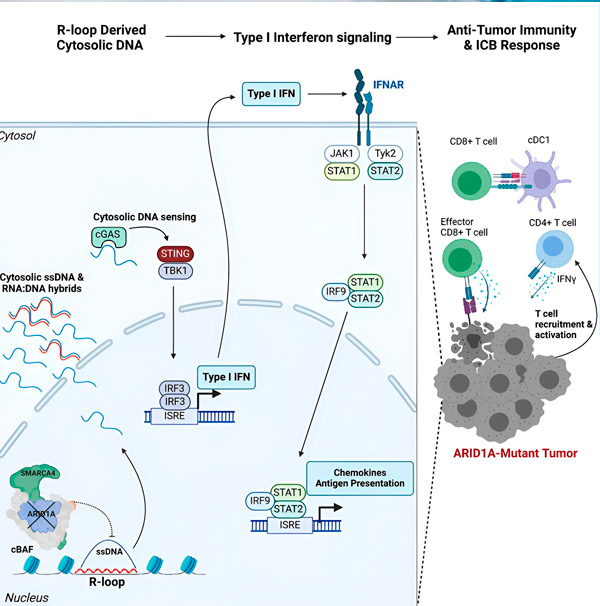
Їхнє нове дослідження, опубліковане в журналі Cell, показує, що мутація ARID1A робить пухлини чутливими до імунотерапії, залучаючи до пухлини імунні клітини, що борються з раком, через противірусну імунну відповідь.
Дослідники припускають, що ця мутація та противірусна імунна відповідь можуть бути використані як біомаркер для кращого відбору пацієнтів для специфічної імунотерапії, такої як блокада імунних контрольних точок. Ці результати також стимулюють розробку препаратів, спрямованих на ARID1A та споріднені білки, щоб зробити інші пухлини чутливішими до імунотерапії.
«Це може суттєво змінити результат лікування раку для пацієнтів», – сказала доцент Діана Харгрівз, старший автор дослідження. «Пацієнти з мутацією ARID1A вже мають імунну відповідь, тому все, що нам потрібно зробити, це посилити цю відповідь за допомогою блокади імунних контрольних точок, щоб допомогти їм знищити свої пухлини зсередини».
Хоча було відомо, що люди з мутаціями ARID1A добре реагують на блокування імунних контрольних точок, точний зв'язок між ними залишався незрозумілим. Щоб пролити світло на механізм, вчені з Інституту Солка використовували мишачі моделі меланоми та колоректального раку як з мутацією ARID1A, так і з функціональним ARID1A.
Джерело: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Команда спостерігала сильну імунну відповідь у всіх моделях з мутацією ARID1A, але не в тих, де ARID1A була функціональною, що підтверджує ідею про те, що мутація ARID1A справді викликає цю відповідь. Але як це працює на молекулярному рівні?
«Ми виявили, що ARID1A відіграє важливу роль у ядрі, підтримуючи належну організацію ДНК», — каже Метью Максвелл, перший автор дослідження та аспірант лабораторії Харгрівза. «Без функціонального ARID1A вільна ДНК може бути вирізана та вивільнена в цитозоль, активуючи бажану противірусну імунну відповідь, яку можна посилити блокуванням імунних контрольних точок».
Ген ARID1A кодує білок, який допомагає регулювати форму нашої ДНК та підтримувати стабільність геному. Коли ARID1A мутує, це запускає ланцюг подій, подібний до того, що відбувається у Руба Голдберга, у ракових клітинах.
По-перше, відсутність функціонального ARID1A призводить до вивільнення ДНК у цитозоль. Потім цитозольна ДНК активує противірусну систему сигналізації, шлях cGAS-STING, оскільки наші клітини адаптовані до позначення будь-якої ДНК у цитозолі як чужорідної для захисту від вірусних інфекцій. Зрештою, шлях cGAS-STING залучає імунну систему до залучення Т-клітин до пухлини та активації їх у спеціалізовані Т-клітини-кілери раку.
На кожному кроці, залежно від попереднього, цей ланцюг подій — мутація ARID1A, вихід ДНК, сигналізація cGAS-STING, рекрутинг Т-клітин — призводить до збільшення кількості Т-клітин, що борються з раком, у пухлині. Блокада імунних контрольних точок може бути використана для забезпечення активації цих Т-клітин, що підвищує їхню здатність перемагати рак.
«Наші результати відкривають новий молекулярний механізм, за допомогою якого мутація ARID1A може сприяти протипухлинній імунній відповіді», — каже Харгрівз. «Цікавим у цих відкриттях є їхній трансляційний потенціал. Ми можемо використовувати мутації ARID1A для відбору пацієнтів для блокування імунних контрольних точок, і тепер ми бачимо механізм, за допомогою якого препарати, що інгібують ARID1A або його білковий комплекс, можуть бути використані для подальшого посилення імунотерапії в інших пацієнтів».
Описуючи механізм, за допомогою якого блокування імунних контрольних точок є більш ефективним при раку з мутацією ARID1A, дослідники надають клініцистам обґрунтування для пріоритетності цієї імунотерапії для пацієнтів з мутацією ARID1A. Ці висновки є важливим кроком до персоналізації лікування раку та надихають на розробку нових методів лікування, спрямованих на ARID1A та його білковий комплекс.
У майбутньому команда Інституту Солка сподівається, що їхні висновки покращать результати лікування пацієнтів з різними видами раку, пов'язаними з мутаціями ARID1A, і має намір дослідити цей клінічний переклад у співпраці з Каліфорнійським університетом у Сан-Дієго.
