Нові публікації
Нові генетичні механізми можуть стати терапевтичною мішенню проти гліоми
Останній перегляд: 02.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Дослідження, проведене в лабораторії Ши-Юань Чена, доктора філософії, професора відділення нейроонкології Кена та Рут Дейві на кафедрі неврології, виявило нові механізми, що лежать в основі альтернативних подій сплайсингу РНК у пухлинних клітинах гліоми, які можуть служити новими терапевтичними мішенями. Результати дослідження опубліковані в журналі Journal of Clinical Investigation.
«Ми знайшли інший спосіб лікування гліоми через призму альтернативного сплайсингу та відкрили нові мішені, які раніше не були ідентифіковані, але є важливими для злоякісності гліоми», — сказав Сяо Сун, доктор медичних наук, доктор філософії, доцент кафедри неврології та провідний автор дослідження.
Гліоми є найпоширенішим типом первинних пухлин головного мозку у дорослих і походять з гліальних клітин, які знаходяться в центральній нервовій системі та підтримують сусідні нейрони. Гліоми дуже стійкі до стандартних методів лікування, включаючи променеву та хіміотерапію, через генетичну та епігенетичну гетерогенність пухлини, що підкреслює необхідність пошуку нових терапевтичних мішеней.
Попереднє дослідження лабораторії Ченга, опубліковане в журналі Cancer Research, показало, що важливий фактор сплайсингу SRSF3 значно підвищений у гліомах порівняно з нормальним мозком, а регульований SRSF3 сплайсинг РНК сприяє росту та прогресуванню гліоми, впливаючи на численні клітинні процеси в пухлинних клітинах.
Сплайсинг РНК – це процес, який включає видалення інтронів (некодуючих ділянок РНК) та об'єднання екзонів (кодуючих ділянок) з утворенням зрілої молекули мРНК, яка підтримує експресію генів у клітині.
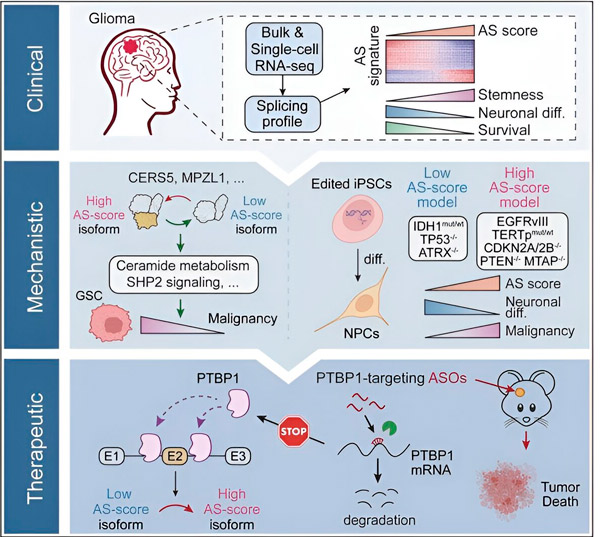
У цьому дослідженні вчені мали на меті виявити зміни в альтернативному сплайсингу в пухлинних клітинах гліоми, механізми, що лежать в основі цих змін, та визначити їхній потенціал як терапевтичних мішеней.
Використовуючи обчислювальні методи та технології секвенування РНК, дослідники дослідили зміни сплайсингу в пухлинних клітинах гліоми, взятих у зразки пацієнтів. Щоб підтвердити ці зміни, вони використали технології редагування генів CRISPR для введення різних мутацій драйвера гліоми в моделі гліоми, отримані з індукованих плюрипотентних стовбурових клітин людини (iPSC).
Вони виявили, що ці зміни сплайсингу посилюються варіантом рецептора епідермального фактора росту III (EGFRIII), який, як відомо, надмірно експресується в багатьох пухлинах, включаючи гліоми, та пригнічуються мутацією в гені IDH1.
Дослідники підтвердили функцію двох подій сплайсингу РНК, які створюють різні ізоформи білків з різними амінокислотними послідовностями.
«Лише одна з цих ізоформ може сприяти росту пухлини, на відміну від іншої ізоформи, яка зазвичай експресується в нормальному мозку. Пухлини використовують цей механізм для вибіркової експресії ізоформи, що сприяє росту пухлини, над ізоформою нормального мозку», – сказав Сонг.
Потім команда проаналізувала білки, що зв'язують РНК вище за течією, і виявила, що ген PTBP1 регулює сплайсинг РНК, що сприяє розвитку пухлини, в клітинах гліоми. Використовуючи ортотопічну модель гліоми на імунодефіцитних мишах, дослідники цілеспрямовано впливали на PTBP1 за допомогою терапії на основі антисенсових олігонуклеотидів (ASO), що зрештою пригнічувало ріст пухлини.
«Наші дані підкреслюють роль альтернативного сплайсингу РНК у впливі на злоякісність та гетерогенність гліоми, а також його потенціал як терапевтичної вразливості для лікування дорослих гліом», – пишуть автори дослідження.
Наступним кроком для дослідників є вивчення потенціалу таргетування PTBP1 для викликання протипухлинної імунної відповіді, сказав Сонг.
«Використовуючи аналіз РНК-секвенування з довгим зчитуванням, ми виявили, що таргетування PTBP1 у клітинах гліоми призводить до утворення кількох альтернативно сплайсованих транскриптів, які відсутні в нормальних тканинах. Тому наш наступний проект — з’ясувати, чи може ця ізоформа генерувати деякі антигени, щоб імунна система могла краще розпізнавати пухлину», — сказав Сонг.
Сонг також додав, що їхня команда зацікавлена в аналізі змін сплайсингу в непухлинних клітинах пацієнтів з гліомою, таких як імунні клітини.
«Ми вже знаємо, що сплайсинг дуже важливий для регулювання функцій клітини, тому він має не лише регулювати злоякісність пухлини, але й може регулювати функцію імунних клітин, щоб визначити, чи можуть вони ефективно знищувати рак. Тому ми також проводимо деякі біоінформаційні аналізи імунних клітин, інфільтрованих пухлиною, щоб побачити, чи відбуваються зміни в сплайсингу після того, як імунна клітина інфільтрувала пухлину».
«Наша мета — визначити роль альтернативного сплайсингу у формуванні імуносупресивного мікрооточення пухлини та виявити потенційні мішені для підвищення ефективності імунотерапії при гліомі», — сказав Сонг.
