Медичний експерт статті
Нові публікації
Експериментальні моделі остеоартрозу
Останній перегляд: 07.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
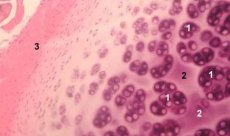
Хрящ – це високоспеціалізована тканина, що містить лише один тип клітин (хондроцити) та характеризується відсутністю кровоносних та лімфатичних судин. Хрящ харчується переважно за рахунок поглинання із синовіальної рідини. Метаболізм хондроцитів регулюється низкою розчинних факторів, що виробляються локально хондроцитами та навколишніми тканинами. Функція хондроцитів також залежить від складу позаклітинного середовища (напруга кисню, концентрація іонів, pH тощо), складу позаклітинної маси (ECM), взаємодії клітин і матриксу, а також фізичних сигналів. Основною метою експериментального моделювання є створення культур у позаклітинному середовищі без зміни фенотипу зрілих клітин. Друга мета – створення культур для вивчення передчасної, уповільненої, короткочасної або тривалої реакції хондроцитів на хімічні та/або фізичні сигнали. Дослідження in vitro також надають можливість вивчати поведінку хондроцитів при остеоартрозі. Третя мета – розробка систем кокультурування, які дозволяють вивчати взаємодію різних тканин у суглобі. Четвертим завданням є підготовка хрящових імплантатів до подальшої трансплантації. І нарешті, п'яте завдання — це вивчення факторів росту, цитокінів або терапевтичних засобів, здатних стимулювати репарацію та/або пригнічувати резорбцію хряща.
Протягом останніх десятиліть було створено різні моделі культур клітин суглобового хряща, включаючи моношарові культури, суспендовані культури, хондронні культури, експлантати, кокультури та безсмертні клітинні культури. Кожна культура має свої переваги та недоліки, і кожна з них підходить для вивчення одного конкретного аспекту метаболізму хондроцитів. Таким чином, хрящові експлантати є чудовою моделлю для вивчення обміну матриксних елементів, що вимагає справжніх рецепторів клітинної поверхні та нормальної взаємодії клітина-матрикс та матрикс-клітина. Водночас рекомендується вивчати матриксні відкладення або механізми, що регулюють метаболізм хондроцитів, на культурі ізольованих клітин. Моношарна культура низької щільності необхідна для вивчення процесу диференціації клітин. Культури, суспендовані в природному або синтетичному матриксі, є моделлю для аналізу адаптивної реакції хондроцитів на механічний стрес.
Хондроцитарні культури
При виборі хрящової тканини для досліджень in vitro слід враховувати кілька важливих моментів. Склад матриксу та метаболічна активність хондроцитів варіюються між суглобами, а остання також залежить від глибини розташування хондроцитів у тканині. Ці дані були отримані в кількох експериментах, в яких вивчалися ізольовані субпопуляції хондроцитів з хрящових зон різної глибини. Було виявлено ряд морфологічних та біохімічних відмінностей між культивованими хондроцитами, розташованими в поверхневих та глибоких шарах суглобового хряща. Поверхневі клітини синтезують розріджений, бідний на протеоглікани фібрилярний матрикс, тоді як глибші клітини продукують матрикс, багатий на фібрили та протеоглікани. Крім того, поверхневі клітини продукують відносно більше дрібних неагрегованих протеогліканів та гіалуронової кислоти та відносно менше агрекану та кератансульфату, ніж глибші хондроцити. Ще однією важливою відмінною рисою метаболізму хондроцитів, виділених з хрящових зон різної глибини, є реакція на екзогенний подразник. За даними М. Айделотта та ін., бичачі хондроцити з поверхневої зони хряща були чутливішими до IL-1, ніж клітини з глибокої зони.
Поведінка клітин також залежить від розташування тканини. Хондроцити з реберного та вушного хряща однієї й тієї ж тварини по-різному реагують на фактори росту, такі як фактор росту фібробластів (FGF) та TGF-бета. FGF збільшував включення тимідину, проліну та лейцину в культивовані ребра, але не в хондроцити вуха. TGF-бета збільшував включення тимідину в хондроцити реберного та вушного хряща, але не впливав на включення тимідину та проліну в хондроцити вуха. Клітини хряща з ділянок високого навантаження відрізняються від клітин з ділянок низького навантаження на хрящ. Таким чином, хондроцити зрілого хряща колінного суглоба овець з центральної області суглобової поверхні великогомілкової кістки, не покритої меніском, яка несе найбільше навантаження in vivo, синтезують менше агрекану, але більше декорину, ніж клітини із зон, покритих меніском. Автори також наголошують на важливості використання хряща з ідентичних суглобових зон при вивченні синтетичної функції суглобів.
Метаболізм хондроцитів та їхня реакція на регуляторні фактори також суттєво залежать від віку донора, розвитку його скелета та стану суглобів, з яких беруться клітини. У людських хондроцитах спостерігається значне зниження проліферативної відповіді з віком. Найбільше зниження спостерігається у донорів віком 40-50 років та старше 60 років. Більше того, вираженість проліферативної відповіді на фактори росту (наприклад, FGF та TGF-бета) зменшується зі старінням. Окрім кількісних змін у проліферації хондроцитів, спостерігаються також якісні зміни. Клітини молодих донорів (10-20 років) краще реагують на тромбоцитарний фактор росту (PDGF), ніж на TGF-бета, тоді як у клітинах дорослих донорів спостерігається протилежне. Для пояснення вікових змін синтетичної функції хондроцитів та їхньої реакції на фактори росту використовується кілька механізмів. До них належать зменшення кількості та спорідненості поверхневих клітинних рецепторів, зміни синтезу та біоактивності факторів росту та цитокінів, а також модифікація пост-рецепторних сигналів.
Патологічний стан суглобів також змінює морфологію та метаболічну активність хондроцитів. Так, J. Kouri та ін. (1996) виявили три субпопуляції хондроцитів у хрящі при остеоартрозі. Хондроцити з поверхневої та верхньої середньої частини хряща утворюють кластери та синтезують більшу кількість протеогліканів та колагену. TGF-β та інсуліноподібний фактор росту (IGF) здатні стимулювати синтез протеогліканів хондроцитами та частково нейтралізувати вплив IL-1 та TNF-α. Експлантати хряща, ураженого остеоартрозом, та хондроцити, виділені з хряща пацієнта з остеоартрозом, більш чутливі до стимуляції TGF-β, ніж хондроцити здорового хряща. Ці відмінності, найімовірніше, пов'язані з фенотипічними змінами хондроцитів у верхніх шарах суглобового хряща.
Виділення окремих хондроцитів досягається шляхом послідовної обробки позаклітинного матеріалу (ECM) протеолітичними ферментами. Після їх вивільнення з ECM ізольовані клітини ідеально підходять для вивчення de novo синтезу компонентів матриксу. Деякі автори використовують лише клостридіальну колагеназу, інші ж попередньо інкубують хрящ з трипсином, проназою, ДНКазою та/або гіалуронідазою. Кількість ізольованих клітин залежить від використовуваних ферментів. Таким чином, при обробці лише колагеназою з 1 г тканини можна отримати 1,4-10⁶ хондроцитів, тоді як при використанні пронази, гіалуронідази та колагенази -4,3-10⁶. При обробці колагеназою агрекан, білки, IL-6 та IL-8 залишаються в культурі клітин у значно більших кількостях, ніж при послідовній обробці різними ферментами. Існує кілька пояснень цих відмінностей між двома культурами клітин:
- Клітинні рецептори пошкоджуються або інгібуються ферментами, TGF-β пригнічує синтез ДНК та протеогліканів у свіжовиділених хондроцитах (1-й день), тоді як синтез ДНК та протеогліканів у хондроцитах, культивованих у моношарі (7 днів), стимулюється TGF-β. Однак, для повторної експресії цих мембранних компонентів потрібен достатній період до початку експерименту.
- Екзогенні протеази можуть порушувати взаємодію клітини з матриксом, опосередковану інтегринами. Сімейство інтегринів сприяє приєднанню хондроцитів до молекул позаклітинного матриксу (Shakibaei M. et al., 1997). Це порушення може впливати на експресію матриксних генів.
- Залишки компонентів матриксу можуть регулювати синтетичну функцію хондроцитів. Інтегрини здатні розпізнавати продукти деградації позаклітинного матриксу, таким чином відіграючи важливу роль у репарації тканин після дії протеолітичних ферментів. Т. Ларссон та ін. (1989) повідомляли, що додавання інтактних або фрагментованих протеогліканів до клітинної культури стимулює синтез білків та протеогліканів. Однак високий рівень гіалуронової кислоти викликає значне зниження включення сульфатів у синтез протеогліканів хондроцитами курячого ембріона, зрілими хондроцитами свині та клітинами хондросаркоми щура. Більше того, гіалуронова кислота є інгібітором вивільнення протеогліканів з клітин навіть у присутності IL-1b, TNF-α, FGF, що вказує на протидію першій біологічній активності факторів росту та цитокінів. Точний механізм дії гіалуронової кислоти залишається незрозумілим; Відомо, що хондроцити містять рецептор для гіалуронової кислоти, пов'язаний з актиновими філаментами цитозолю. Зв'язування гіалуронової кислоти з її рецептором стимулює фосфорилювання білка. Таким чином, ці дані демонструють модуляцію метаболічної функції хондроцитів фрагментованими або нативними молекулами матриксних білків шляхом активації рецепторів клітинних мембран.
- Швидка стимуляція синтезу матриксного білка хондроцитами ферментами може бути наслідком змін форми хондроцитів та/або реорганізації цитоскелета.
- Деякі цитокіни (наприклад, IL-8) та фактори росту (наприклад, IGF-1, TGF-β) секвеструються в позаклітинному матриксі. Найвідомішим прикладом є зв'язування TGF-β декорином, що призводить до зниження здатності першого індукувати ріст клітин у клітинах яєчників китайського хом'яка. Виявлення того, що вміст декорину в хрящі збільшується з віком, свідчить про зниження біодоступності TGF-β зі старінням. Фактори росту та цитокіни можуть вивільнятися з матриксних залишків під час культивування та згодом модулювати функцію хондроцитів.
Моношар культури хондроцитів
Диференційований фенотип хондроцитів характеризується, перш за все, синтезом колагену II типу та тканинно-специфічних протеогліканів, а також низьким рівнем мітотичної активності. Є дані, що при тривалому культивуванні клітин у моношарі, а також після кількох повторних пасажувань клітин, хондроцити втрачають свої сферичні обриси та набувають витягнутої, фібробластоподібної форми. При такій фібробластичній метаплазії також змінюється синтетична функція клітин, що характеризується прогресуючим зниженням синтезу колагенів II, IX та XI типів та збільшенням синтезу колагенів I, III та Y типів. Малі неагреговані протеоглікани синтезуються за рахунок функціонального агрекану. Синтез катепсину B та L надзвичайно низький у диференційованих клітинах, але зростає в процесі втрати диференціації. Колагеназа-1 експресується в диференційованих хондроцитах; при тривалому культивуванні її експресія знижується, тоді як продукція тканинних інгібіторів металопротеїназ (TIMP) зростає.
Диференційовані хондроцити повторно експресують колаген диференційованого фенотипу при перенесенні з моношару в суспендовану культуру. Процес диференціації, ймовірно, пов'язаний з формою клітин. Цю властивість регулярно використовують дослідники, які вивчають дефектні трансплантати з аутологічними хондроцитами. Невелику кількість клітин, отриманих з біопсійного матеріалу, можна розмножити в моношаровій культурі, а потім повторно ввести в тривимірну матрицю перед трансплантацією. Повторна експресія специфічного фенотипу дедиференційованими хондроцитами, перенесеними в агарозну культуру, може бути стимульована TGF-β, осеїн-гідроксиапатитовим комплексом та аскорбіновою кислотою.
У відповідь на фактори росту та цитокіни, хондроцити модифікуються під час процесу диференціації. Клітинна відповідь на цитокіни та фактори росту відрізняється між недиференційованими та диференційованими хондроцитами. IL-1 стимулює проліферацію фібробластів, тоді як ріст недиференційованих хондроцитів пригнічується IL-1. Синтез ДНК стимулюється IGF-1 у видовжених, але не сплющених хондроцитах. У диференційованих хондроцитах стимулюючий вплив IL-1β та TNF-α на продукцію проколагенази більш виражений, ніж у недиференційованих хондроцитах.
Культивування хондроцитів
Культивування хондроцитів у суспензії в рідкому середовищі або в природному чи синтетичному тривимірному матриксі стабілізує фенотип хондроцитів. Клітини зберігають свою сферичну форму та синтезують тканинно-специфічні білки. Суспендована культура хондроцитів зазвичай рекомендується для вивчення формування нового перицелюлярного матриксу. Культури хондроцитів у синтетичних або природних абсорбуючих полімерах використовуються для імплантації клітин у дефекти хряща з метою стимуляції регенерації суглобової хрящової тканини. Синтетичне або природне середовище для імплантованих клітин повинно відповідати ряду вимог:
- імплантати повинні мати пористу структуру для адгезії та росту клітин,
- ні сам полімер, ні продукти його розпаду не повинні викликати запалення або токсичних реакцій при імплантації in vivo,
- трансплантат повинен мати здатність з'єднуватися з сусіднім хрящем або субхондральною кісткою,
- натуральна або синтетична матриця повинна мати здатність до абсорбції, її розпад має бути збалансований регенерацією тканин,
- Для сприяння відновленню хряща хімічна структура та архітектура пор матриксу повинні сприяти підтримці клітинного фенотипу та синтезу тканинно-специфічних білків хондроцитами, розміщеними в ньому,
- Під час імплантації in vivo необхідно вивчати механічні властивості синтетичної або природної матриці.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Суспензія хондроцитів у рідкій фазі
Прикріпленню клітин до пластикових судин, у яких культивуються хондроцити, можна запобігти, покриваючи їх стінки розчином метилцелюлози, агарози, гідрогелю (полі-2-гідроксіетилметакрилату) або сумішшю колагену та агарози. За цих умов хондроцити утворюють кластери та синтезують переважно агрекан та тканинно-специфічні колагени (II, IX, XI типів). Зазвичай виявляються два типи клітин. Клітини, розташовані в центрі, зберігають сферичну форму та оточені добре розвиненим позаклітинним матриксом (ECM), що підтверджується гістохімічними та ультраструктурними дослідженнями. На периферії хондроцити мають дископодібні обриси та оточені розрідженим ECM; про функціональні характеристики таких клітин відомо мало.
Хондроцити можна культивувати на мікроносіях, що підтримуються в суспензії; як мікроносії використовуються декстранові кульки (цитодекс), декстранові кульки, покриті колагеном (цитодекс III), та непористі мікросфери колагену I типу (целаген). За цих умов культивування хондроцити прикріплюються до поверхні мікроносія, зберігають свою сферичну форму та утворюють матрикоподібний матеріал. Крім того, використання целлагену сприяє проліферації хондроцитів та реекспресії нормального фенотипу. Тому культивування хондроцитів на мікросферах целлагену може бути використано для відновлення клітинного фенотипу перед трансплантацією.
Іншим методом культивування суспензії хондроцитів у рідкому середовищі є їх культивування у вигляді щільних кульок, що складаються з клітин (0,5-1 * 10⁻⁶ ), отриманих центрифугуванням. Такі хондроцити здатні продукувати матрикс, що містить велику кількість протеогліканів, колаген II типу, але не колаген I типу, що підтверджено гістологічними, імуногістохімічними та кількісними методами.
Суспензія хондроцитів у природному позаклітинному матриксі
Хондроцити можна культивувати у суспензії у тривимірній матриці (м'який агар, агароза, колагеновий гель або губка, гіалуронова кислота, фібриновий клей, альгінатні кульки).
Хондроцити, культивовані в агарозі, зберігають свій нормальний фенотип і синтезують колаген II типу та тканинно-специфічні агрегати агреканів. При культивуванні в агарозі протеоглікани, синтезовані клітиною, вивільняються в середовище протягом 50 днів. Для порівняння, в моношаровій культурі клітинна фаза переповнена глікозаміногліканами вже в перші 5-6 днів культивування; при культивуванні в середовищі, після посилення синтезу та вивільнення глікозаміногліканів у перші 8-10 днів, відбувається їх залежне від часу зменшення. Тим не менш, поведінка хондроцитів при культивуванні в агарозі відрізняється від такої in vivo. В агарозі велика кількість синтезованих агрегатів агреканів містить менші молекули та менше молекул, ніж in vivo. TGF-β стимулює синтез протеогліканів в експлантаті, але знижує синтез агреканів в агарозі.
Альгінат – це лінійний полісахарид, отриманий з бурих морських водоростей. У присутності двовалентних катіонів, таких як іони Ca2 +, цей полімер перетворюється на гель. Кожен хондроцит, захоплений в альгінат, оточений матрицею негативно заряджених полісахаридів, пори якої порівнянні з порами гіалінового хряща. Матрикс, утворений хондроцитами в альгінатних кульках, складається з двох компартментів – тонкого шару клітинно-асоційованого матриксу, що відповідає перицелюлярному та територіальному матриксу суглобового хряща, та більш віддаленого матриксу, еквівалентного інтертериторіальному в нативній тканині. На 30-й день культивування відносний та абсолютний об'єм, займаний клітинами та кожним із двох компартментів в альгінатній кульці, майже повністю ідентичний таким у нативному хрящі. Протягом майже 30 днів хондроцити зберігають свою сферичну форму та продукують агрекан, гідродинамічні властивості якого подібні до властивостей молекул агрекану в матриксі суглобового хряща, а також молекули колагену II, IX та XI типів. Водночас, як і в інших суспензійних культурах, на поверхні альгінатних кульок присутні сплющені клітини, які продукують невелику кількість молекул колагену I типу, що безпосередньо вивільняються в середовище та не включаються до позаклітинного матриксу. В альгінатних кульках спостерігається помірна проліферація хондроцитів. Після 8 місяців культивування в альгінатному гелі зрілі хондроцити не втрачають метаболічної активності та продовжують синтезувати тканинно-специфічний колаген II типу та агрекан.
Х. Танака та ін. (1984) досліджували дифузійні властивості різних природних молекул в альгінату та виявили, що молекули масою понад 70 кДа не дифундують через альгінат. Таким чином, культура клітин в альгінату підходить для вивчення регуляції біосинтезу матриксу та організації позаклітинного матриксного матриксу. Наявність клітин, культивованих в альгінату, дозволяє вивчати дію регуляторних факторів пептидів та фармакологічних агентів на транскрипційному, посттранскрипційному та трансляційному рівнях.
Хондроцити також культивують у матриці колагенових волокон I та II типів. С. Нерер та ін. (1997) порівнювали функціонування хондроцитів собак у пористих колаген-протеогліканових полімерних матрицях, що містять колагени різних типів. Вони виявили важливі відмінності в морфології біосинтетичної функції хондроцитів, культивованих у колагенових матрицях, що містять колаген I та II типів. Клітини в матриці колагену II типу зберігали свою сферичну форму, тоді як у колагені I типу вони мали фібробластоподібну морфологію. Більше того, в матриці колагену II типу хондроцити продукували більшу кількість глікозаміногліканів. Й. ван Сусанте та ін. (1995) порівнювали властивості хондроцитів, культивованих в альгінатному та колагеновому (тип I) гелі. Автори виявили значне збільшення кількості клітин у колагеновому гелі, але з 6-го дня культивування клітини втрачали свій характерний фенотип, перетворюючись на фібробластоподібні клітини. В альгінатному гелі спостерігалося зменшення кількості клітин, але хондроцити зберігали свій нормальний фенотип. У колагеновому гелі кількість протеогліканів на клітину була значно вищою, ніж в альгінаті, але в гелі спостерігалося зниження синтезу матричних елементів, починаючи з 6-го дня культивування, тоді як в альгінаті синтез продовжував зростати.
Тверда тривимірна фібринова матриця – це природна речовина, яка підтримує хондроцити, суспендовані в ній, у диференційованому фенотипі. Тривимірна фібринова матриця також може бути використана як носій при трансплантації хондроцитів. Перевагами фібрину є відсутність цитотоксичності, здатність заповнювати простір та адгезивна здатність. Гістологічні та біохімічні дослідження, авторадіографія та електронна мікроскопія показали, що хондроцити у фібриновому гелі зберігають свою морфологію, проліферують та утворюють матрикс навіть після 2 тижнів культивування. Однак, Г. Хоммінга та ін. (1993) повідомляли, що розпад фібрину починається після 3 днів культивування, і дедиференціація хондроцитів прогресує.
Суспензія хондроцитів у штучному (синтетичному) позаклітинному матриксі (ECM)
Хрящові імплантати для реконструктивної або ортопедичної хірургії можна отримати шляхом вирощування ізольованих хондроцитів in vitro в синтетичній біосумісній матриці.
Хондроцити, культивовані в полігліколевій кислоті, проліферують і зберігають нормальну морфологію та фенотип протягом 8 тижнів. Комплекс хондроцитів-полігліколевої кислоти складається з клітин, глікозаміногліканів, колагенів та має зовнішню колагенову капсулу. Однак такі імплантати містять два типи молекул колагену - I та II. Імплантати з хондроцитів, дедиференційованих серією пасажувань, мають більшу кількість глікозаміногліканів та колагенів, ніж імплантати з первинно недиференційованих хондроцитів.
Л. Фрід та ін. (1993b) порівнювали поведінку культур хондроцитів людини та великої рогатої худоби у фіброзній полігліколевій кислоті (FPGA) та пористій полімолочній кислоті (PPLA). Після 6-8 тижнів культивування хондроцитів великої рогатої худоби у FPGA або PPLA автори спостерігали проліферацію клітин та регенерацію хрящової матриці. У FPGA хондроцити мали сферичну форму та розташовувалися в лакунах, оточених хрящовою матрицею. Після 8 тижнів культивування in vitro регенерована тканина містила до 50% сухої речовини (4% клітинної маси, 15% глікозаміногліканів та 31% колагену). У PPLA клітини мали веретеноподібну форму та невелику кількість глікозаміногліканів та колагену. У FPGA ріст клітин був у 2 рази інтенсивнішим, ніж у PPLA. In vivo хондроцити, вирощені в VPGK та PPLC, протягом 1-6 місяців утворювали тканину, гістологічно подібну до хряща. Імплантати містили глікозаміноглікани, колагени I та II типу.
Хондроцити великої рогатої худоби культивували в пористому гідрофобному та гідрофільному поліетилені високої щільності. Після 7 днів інкубації в обох субстратах клітини зберегли сферичну форму та містили переважно колаген II типу. Після 21 дня культивування було виявлено, що гідрофільний матрикс містить більше колагену II типу, ніж гідрофобний матрикс.
Хрящову тканину також можна отримати шляхом культивування в моношарі на фільтрах Millicell-CM. Попереднє покриття фільтрів колагеном необхідне для прикріплення хондроїтинів. Гістологічне дослідження культури демонструє накопичення хондроцитів в позаклітинному хрящі (ECM), що містять протеоглікани та колаген II типу. Колаген I типу в такій культурі не виявлено. Хондроцити в отриманій хрящовій тканині мають сферичну форму, але на поверхні тканини вони дещо сплющені. Товщина новоутвореної тканини збільшувалася з часом і залежала від початкової щільності клітинного моношару. За оптимальних умов культивування товщина хрящової тканини досягала 110 мкм, організація її клітин та колагену в поверхневі та глибокі шари подібна до організації суглобового хряща. ECM містить приблизно в 3 рази більше колагену та протеогліканів. Через 2 тижні культивування спостерігалося накопичення матриксу, що дозволило витягти тканину з фільтра та використати її для трансплантації.
Сімс та ін. (1996) вивчали культивування хондроцитів у поліетиленоксидному гелі, інкапсульованій полімерній матриці, що дозволяє переносити велику кількість клітин шляхом ін'єкції. Через шість тижнів після ін'єкції в підшкірну тканину атимічних мишей утворювався новий хрящ, який морфологічно характеризувався білою опалесценцією, подібною до гіалінового хряща. Гістологічні та біохімічні дані вказували на наявність активно проліферуючих хондроцитів, що продукують позаклітинний хрящ.
Експлантація
Експлантація хрящової тканини використовується для вивчення процесів ана- та катаболізму в ній, підтримки гомеостазу, резорбції та репарації. Хондроцити в хрящових експлантатах зберігають нормальний фенотип та склад позаклітинної маси (ECM), подібний до таких у суглобовому хрящі in vivo. Після 5 днів культивування у присутності сироватки досягається постійний рівень синтезу та природних процесів деградації. Резорбцію тканин можна прискорити в основній культурі та в культурі з додаванням сироватки за допомогою низки агентів, таких як IL-IB, TNF-a, бактеріальні ліпополісахариди, похідні ретиноєвої кислоти або активні кисневі радикали. Для вивчення репарації хряща його пошкодження індукується розчинними медіаторами запалення (H 2 O 2, IL-1, TNF-a) або фізичним розривом матриксу.
Метод органотипового культивування є моделлю для досліджень in vitro впливу ізольованих зовнішніх факторів на хондроцити та навколишній матрикс. In vivo хондроцити розташовані рідко в позаклітинному матриксі та не контактують один з одним. Культура експлантату суглобового хряща зберігає цю структурну організацію, а також специфічні взаємодії між хондроцитами та навколишнім позаклітинним середовищем. Ця модель також використовується для вивчення впливу механічного стресу, фармакологічних агентів, факторів росту, цитокінів та гормонів на метаболізм хряща.
Ще однією перевагою експлантації хрящової тканини є відсутність пошкодження хондроцитів під дією протеолітичних ферментів або механічних факторів, що неминуче при виділенні клітин. Рецептори та інші мембранні білки та глікопротеїни захищені від пошкоджуючих факторів.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Хондронна культура
Хондрон – це структурна, функціональна та метаболічна одиниця суглобового хряща, що складається з хондроцита, його перицелюлярної матриці та компактної ниткоподібної капсули, і відповідає за гомеостаз матриксу. Хондрони механічно витягуються з хряща та збираються за допомогою кількох послідовних низькошвидкісних гомогенізацій. Хондрони, виділені із зон різної глибини хряща, можна розділити на чотири категорії: один хондрон, парні хондрони, множинні (три або більше) лінійно розташовані хондрони (колони хондронів) та скупчення хондронів.
Поодинокі хондрони зазвичай знаходяться в середніх шарах інтактного хряща, парні хондрони знаходяться на межі середнього та глибокого шарів, лінійно розташовані множинні хондрони типові для глибоких шарів інтактного хряща. Нарешті, кластери хондронів складаються з хаотично організованих груп поодиноких та парних хондронів, які зберігають агрегований стан після гомогенізації. Кластери хондронів - це великі фрагменти хряща, зазвичай містять кілька хондронів та радіально розташовані колагенові фібрили, тобто типову організацію, характерну для глибоких шарів матриксу. Хондрони іммобілізовані в прозорій агарозі, що дозволяє вивчати їх структуру, молекулярний склад та метаболічну активність. Система хондрон-агароза вважається мікромоделлю хряща, яка відрізняється від традиційної системи хондроцити-агароза тим, що зберігається природне мікрооточення, і немає потреби в його синтезі та складанні. Культура хондронів є моделлю для вивчення взаємодії клітин та матриксу в суглобовому хрящі за нормальних та патологічних умов.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Культура безсмертних хондроцитів
Для створення постійних клітинних ліній використовуються рекомбінантна ДНК або віруси, що містять онкогени, здатні зробити клітину «безсмертною». Безсмертні хондроцити мають здатність до нескінченного розмноження, зберігаючи стабільний фенотип. Ф. Маллейн-Герін та ін. (1995) показали, що онкоген SV40T індукує проліферацію хондроцитів миші, які продовжують стабільно експресувати колаген II, IX та XI типів, а також суглобовий агрекан та зв'язуючий білок. Однак така клітинна лінія набуває здатності синтезувати колаген I типу при культивуванні її в моношаровій культурі або в агарозному гелі.
В. Хортон та ін. (1988) описали лінію безсмертних клітин з низьким рівнем експресії мРНК колагену II типу. Ці клітини були отримані шляхом їх трансформації мишачим ретровірусом, що містить I-myc- та y-ra-онкогени. Цей тип клітин являє собою унікальну модель для вивчення взаємодій суглобового матриксу за відсутності колагену II типу, а також регуляції синтезу колагену II типу.
Культура хондропротів з мутованими або делетованими генами є зручною моделлю для вивчення їхньої фізіологічної функції. Ця модель особливо підходить для вивчення ролі специфічних молекул в організації хрящової матриці або для дослідження впливу різних регуляторних факторів на метаболізм хряща. Хондроцити з делетованим геном колагену IX типу синтезують колагенові фібрили, які ширші за норму, що вказує на те, що колаген IX типу регулює діаметр фібрил. Як зазначалося в розділі 1, нещодавно в сім'ях з первинним генералізованим остеоартритом була виявлена мутація в гені COLAI, що кодує колаген II типу. Щоб вивчити вплив мутантного колагену II типу на суглобову матрицю, Р. Дхармрварам та ін. (1997) трансфікували (інфікували чужорідною нуклеїновою кислотою) дефектний COL 2 AI (аргінін у положенні 519 замінений цистеїном) у хондроцити людського плода in vitro.
Система кокультури. У суглобі хрящ взаємодіє з іншими типами клітин, що містяться в синовіальній оболонці, синовіальній рідині, зв'язках та субхондральній кістці. На метаболізм хондроцитів можуть впливати різні розчинні фактори, що синтезуються перерахованими клітинами. Так, при артриті суглобовий хрящ руйнується протеолітичними ферментами та вільними радикалами, що виробляються синовіальними клітинами. Тому були розроблені моделі для вивчення складних взаємодій між хрящем та навколишніми тканинами, які називаються кокультурами.
С. Лакомб-Глейз та ін. (1995) культивували хондроцити та остеобласти кроликів у системі спільного культивування (COSTAR), в якій клітини були розділені мікропористою мембраною (0,4 мкм), що дозволяло обмін між двома типами клітин без будь-яких прямих контактів. Це дослідження продемонструвало здатність остеобластів стимулювати ріст хондроцитів за допомогою розчинних медіаторів.
А. М. Мальфе та співавтори (1994) досліджували взаємозв'язок між моноцитами периферичної крові та хондроцитами. Ця модель зручна для вивчення цитокін-опосередкованих процесів при запальних артропатіях (ревматоїдний артрит, серонегативні спондилоартрити тощо). Автори моделі розділили клітини за допомогою мембрани, що зв'язує білок, з порами діаметром 0,4 мкм. Дослідження показало, що моноцити, стимульовані ліпополісахаридом, продукували IL-1 та TNF-α, які пригнічували синтез агрекану хондроцитами та сприяли деградації вже синтезованих агрегатів агрекану.
К. Тада та ін. (1994) створили модель кокультури, в якій ендотеліальні клітини в колагеновому (тип I) гелі розміщували у внутрішній камері, відокремленій від зовнішньої камери з розміщеними в ній хондроцитами фільтром з розміром пор 0,4 мкм. У стані повної ізоляції від зовнішньої камери ендотеліальні клітини людини утворювали трубочки в колагеновому гелі в присутності EGF або TGF-α. При одночасному культивуванні обох типів клітин TGF-α-залежне утворення трубочок ендотеліальними клітинами гальмувалося. Гальмування цього процесу хондроцитами частково усувалося антитілами проти TGF-β. Можна припустити, що TGF-β, що продукується хондроцитами, гальмує васкуляризацію самого хряща.
С. Грут та ін. (1994) одночасно культивували хондроцити з гіпертрофічної та проліферативної зон кістки 16-денного плода миші з шматочками тканини мозку. Через 4 дні культивування спостерігалася трансдиференціація хондроцитів в остеобласти та початок формування остеоїдів. Через 11 днів культивування частина хряща була заміщена кістковою тканиною, а кістковий матрикс частково кальцифікований. Деякі нейропептиди та нейромедіатори, що виробляються тканиною мозку, впливають на метаболізм остеобластів або мають до них рецептори. Серед них норадреналін, вазоактивний кишковий пептид, пептид, пов'язаний з геном кальцитоніну, речовина Р та соматостатин. Шматочки тканини мозку, культивовані разом з хондроцитами, можуть продукувати деякі з перелічених факторів, здатних індукувати процес трансдиференціації хондроцитів в остеобласти.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Вплив зовнішніх факторів на культуру хондроцитів
Вплив напруги кисню на метаболізм хондроцитів
У більшості випадків культури хондроцитів розвиваються в умовах атмосферного тиску кисню. Однак добре відомо, що in vivo хондроцити існують в умовах гіпоксії, а тиск кисню змінюється за різних патологічних станів. Під час процесу дозрівання спостерігаються значні зміни кровопостачання епіфізів. Оскільки васкуляризація варіюється в різних зонах ростової пластинки, то тиск кисню в них також змінюється. К. Брайтон та Р. Хеппенсталл (1971) продемонстрували, що в великогомілковій пластинці кроликів тиск кисню в гіпертрофічній зоні нижчий, ніж в навколишньому хрящі. Вимірювання деяких метаболічних параметрів показали, що хондроцити здатні швидко реагувати на локальні зміни концентрації кисню. Перш за все, при низькому тиску кисню зменшується його споживання хондроцитами. Зі зниженням тиску кисню з 21 до 0,04% збільшується утилізація глюкози, збільшується активність гліколітичних ферментів та синтез молочної кислоти. Навіть при низькому тиску кисню абсолютна кількість АТФ, АДФ та АМФ залишається стабільною. Ці дані свідчать про те, що метаболізм хондроцитів спрямований на максимальне збереження енергії. Однак синтетична активність, а отже, і процеси репарації, змінюються в умовах гіпоксії.
Високий тиск кисню також впливає на метаболізм хондроцитів, спричиняючи зниження синтезу протеогліканів та ДНК, а також деградацію хрящової матриці. Ці ефекти зазвичай супроводжуються утворенням вільних кисневих радикалів.
Вплив концентрації іонів та осмотичного тиску навколишнього середовища на функцію хондроцитів
У нативному хрящі концентрація іонів суттєво відрізняється від концентрації в інших тканинах: вміст натрію в позаклітинному середовищі становить 250-350 ммоль, а його осмолярність — 350-450 мосмоль. Коли хондроцити виділяють з позаклітинного хряща та інкубують у стандартному середовищі (DMEM (мінімальне есенціальне середовище Дульбекко), осмолярність 250-280,7 мосмоль), середовище, що оточує клітини, різко змінюється. Крім того, концентрація кальцію та калію в стандартному середовищі значно нижча, ніж у нативній тканині, а концентрація аніонів значно вища.
Додавання сахарози до середовища підвищує його осмолярність та індукує тимчасове внутрішньоклітинне збільшення концентрації аніонів H + та кальцію в цитозолі. Такі внутрішньоклітинні зміни можуть впливати на процеси диференціації хондроцитів та їх метаболічну активність. J. Urban et al. (1993) виявили, що включення 35-8 -сульфату та 3H -проліну ізольованими хондроцитами, інкубованими у стандартному середовищі DMEM протягом 2-4 годин, становило лише 10% від такого в нативній тканині. Інтенсивність синтезу досягала максимуму при осмолярності позаклітинного середовища 350-400 мосмоль як у свіжоізольованих хондроцитах, так і в експлантатах хрящової тканини. Більше того, об'єм хондроцитів збільшувався на 30-40% після розміщення ізольованих клітин у стандартному середовищі DMEM заданої осмолярності. Однак, при культивуванні хондроцитів в умовах нефізіологічної осмолярності протягом 12-16 годин клітини адаптуються до нових умов, знижуючи інтенсивність біосинтезу пропорційно зміщенню осмолярності позаклітинного середовища.
П. Боргетті та ін. (1995) вивчали вплив осмолярності позаклітинного середовища на ріст, морфологію та біосинтез хондроцитів свині. Автори продемонстрували подібні біохімічні та морфологічні особливості хондроцитів, культивованих у середовищах з осмолярністю 0,28 та 0,38 мосмоль. При осмолярності середовища 0,48 мосмоль спостерігалося зниження проліферації клітин та синтезу білка протягом перших 4-6 годин культивування, але згодом ці параметри відновлювалися та зрештою досягали контрольних значень. При культивуванні хондроцитів у середовищі з осмолярністю 0,58 мосмоль клітини втрачали здатність підтримувати фізіологічну інтенсивність проліферативних процесів, і через 6 днів кількість хондроцитів значно зменшувалася. При осмолярності середовища 0,58 мосмоль спостерігалося глибоке пригнічення синтезу білка. Крім того, при культивуванні в середовищах з осмолярністю 0,28-0,38 мОсм хондроцити зберігають свій фізіологічний фенотип; при вищій осмолярності (0,48-0,58 мОсм) відбуваються значні зміни в морфології клітин, що проявляється втратою характерного фенотипу, перетворенням хондроцитів на фібробластоподібні клітини та втратою здатності клітин збирати матриксні протеоглікани. Результати цього дослідження свідчать про здатність хондроцитів реагувати на обмежені коливання осмолярності позаклітинного середовища.
Зміни концентрації інших іонів також можуть впливати на процеси біосинтезу в хондроцитах. Так, ступінь включення 35S (сульфату) збільшується вдвічі зі збільшенням концентрації іонів калію від 5 ммоль (концентрація у стандартному середовищі DM EM) до 10 ммоль (концентрація в позаклітинному середовищі in vivo). Концентрації кальцію нижче 0,5 ммоль сприяли виробленню колагену зрілими хондроцитами великої рогатої худоби, тоді як концентрація 1-2 ммоль (що відповідає концентрації у стандартному середовищі DM EM) спричиняла значне зниження синтезу колагену. Помірне збільшення біосинтезу спостерігалося при високих рівнях кальцію (2-10 ммоль). Різні катіони беруть участь у прикріпленні хондроцитів до білків позаклітинного середовища. Так, іони магнію та марганцю забезпечують прикріплення до фібронектину та колагену II типу, тоді як іони кальцію не беруть участі у прикріпленні хондроцитів до білків. Таким чином, результати описаних досліджень свідчать про вплив змін позаклітинних іонів калію, натрію, кальцію та осмолярності середовища на біосинтетичну функцію хондроцитів, інкубованих у стандартних середовищах.
Вплив механічного стресу на метаболізм хондроцитів
Іммобілізація суглобів викликає оборотну атрофію хряща, що вказує на необхідність механічних стимулів для нормальних метаболічних процесів у позаклітинному матриксі. У більшості випадків використовувані моделі клітинних культур існують за нормального атмосферного тиску. М. Райт та ін. (1996) показали, що механічне середовище впливає на метаболізм хондроцитів, реакція клітин залежить від інтенсивності та частоти компресійного навантаження. Експерименти з навантаженням на експлантати інтактного суглобового хряща in vitro продемонстрували зниження синтезу білків та протеогліканів під дією статичного навантаження, тоді як динамічне навантаження стимулює ці процеси. Точні механізми впливу механічного навантаження на хрящ є складними та, ймовірно, пов'язані з деформацією клітин, гідростатичним тиском, осмотичним тиском, електричним потенціалом та поверхневими клітинними рецепторами для молекул матриксу. Для вивчення впливу кожного з цих параметрів необхідно створити систему, в якій один параметр можна змінювати незалежно. Наприклад, культура експлантатів не підходить для вивчення деформації клітин, але її можна використовувати для вивчення загального впливу тиску на метаболічну активність хондроцитів. Стиснення хряща призводить до деформації клітин, а також супроводжується виникненням градієнта гідростатичного тиску, електричного потенціалу, потоку рідини та змінами таких фізико-хімічних параметрів, як вміст води в матриксі, густина електричного заряду та рівень осмотичного тиску. Деформацію клітин можна вивчати за допомогою ізольованих хондроцитів, занурених в агарозний або колагеновий гель.
Було розроблено кілька систем для вивчення впливу механічної стимуляції на культуру хондроцитів. Деякі дослідники використовують системи, в яких тиск на культуру клітин прикладається через газову фазу. Так, JP Veldhuijzen та ін. (1979), використовуючи тиск на 13 кПа вище атмосферного з низькою частотою (0,3 Гц) протягом 15 хвилин, спостерігали збільшення синтезу цАМФ та протеогліканів і зменшення синтезу ДНК. R. Smith та ін. (1996) показали, що періодичний вплив гідростатичного тиску (10 МПа) з частотою 1 Гц протягом 4 годин на культуру первинних хондроцитів великої рогатої худоби спричиняв збільшення синтезу агрекану та колагену II типу, тоді як постійний тиск не впливав на ці процеси. Використовуючи подібну систему, Wright та ін. (1996) повідомили, що циклічний тиск на культуру клітин пов'язаний з гіперполяризацією клітинної мембрани хондроцитів та активацією Ca2 + -залежних калієвих каналів. Таким чином, вплив циклічного тиску опосередковується активованими розтягненням іонними каналами в мембрані хондроцитів. Реакція хондроцитів на гідростатичний тиск залежить від умов культивування клітин та частоти прикладеного навантаження. Таким чином, циклічний гідростатичний тиск (5 МПа) зменшує включення сульфату в моношар хондроцитів на частоті 0,05, 0,25 та 0,5 Гц, тоді як на частоті понад 0,5 Гц включення сульфату в хрящовий експлант збільшується.
М. Бушманн та ін. (1992) повідомляли, що хондроцити в агарозних гелях змінюють біосинтез у відповідь на статичне та динамічне механічне навантаження так само, як і культивований інтактний орган. Автори виявили, що механічне навантаження генерує гіперосмотичний стимул з подальшим зниженням pH у хондроцитах.
Вплив механічного розтягування можна вивчати на культурі клітин, зануреній у гель. Силу розтягування можна створювати за допомогою вакууму, керованого комп'ютером. Коли система знаходиться під певним ступенем вакууму, дно чашки Петрі з культурою клітин розтягується на відому величину, деформація максимальна по краях дна чашки та мінімальна в центрі. Розтягування також передається хондроцитам, культивованим у чашці Петрі. Використовуючи цей метод, К. Хольмвалл та ін. (1995) показали, що в клітинах хондросаркоми, культивованих у колагеновому (тип II) гелі, експресія мРНК 2-інтегрину збільшується . 2β-інтегрин здатний зв'язуватися з колагеном II типу. Він вважається механорецептором, оскільки взаємодіє з актин-зв'язуючими білками, таким чином з'єднуючи позаклітинний матрикс (ECM) та цитоскелет.
Вплив pH на метаболізм хондроцитів
PH інтерстиціальної рідини позаклітинного матеріалу хрящової тканини є більш кислим, ніж в інших тканинах. А. Марудас (1980) визначив pH матриксу суглобового хряща на рівні 6,9. Б. Діамант та ін. (1966) виявили pH 5,5 за патологічних умов. Відомо, що хондроцити живуть при низькому PO2, що вказує на важливу роль гліколізу (95% усього метаболізму глюкози) у метаболізмі цих клітин; гліколіз супроводжується продукцією великої кількості молочної кислоти.
Окрім підкислення середовища продуктами гліколізу, самі компоненти матриксу мають велике значення. Велика кількість фіксованого негативного заряду на протеогліканах модифікує позаклітинний іонний склад: спостерігається висока концентрація вільних катіонів (наприклад, H +, Na +, K + ) та низька концентрація аніонів (наприклад, O2, HCO3). Крім того, під впливом механічного навантаження вода витісняється з позаклітинного матриксу, що призводить до збільшення концентрації фіксованих негативних зарядів та притягання більшої кількості катіонів до матриксу. Це супроводжується зниженням pH позаклітинного середовища, що впливає на внутрішньоклітинний pH, тим самим змінюючи метаболізм хондроцитів. Р. Вілкін та А. Холл (1995) вивчали вплив pH позаклітинного та внутрішньоклітинного середовища на біосинтез матриксу ізольованими хондроцитами великої рогатої худоби. Вони спостерігали подвійну модифікацію синтезу матриксу зі зниженням pH. Незначне зниження pH (7,4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Вплив складу культурального середовища на метаболізм хондроцитів
Середовище для культивування хондроцитів повинно відповідати експериментальним умовам. В останні роки для оптимізації умов культивування використовується теляча сироватка. Однак, при використанні сироватки необхідно враховувати ряд важливих моментів:
- зовнішній ріст клітин з периферії тканини в культурах органів,
- варіабельність складу сироваток різних серій,
- наявність у них невідомих компонентів,
- підвищений ризик перешкод та артефактів під час вивчення впливу різних біологічних факторів на метаболічну активність клітин.
Прикладом останнього є дослідження впливу EGF на хондроцити хряща у щурів. EGF стимулював включення 3H -тимідину та збільшення вмісту ДНК у культурі. Цей ефект був більш вираженим при низьких концентраціях у сироватці крові (<1%), але при високих концентраціях (>7,5%) ефект зникав.
Загальновідомо, що рівні синтезу та деградації в DMEM, доповненому телячою сироваткою, значно підвищені порівняно з умовами in vivo. Різниця між метаболізмом in vivo та in vitro може бути зумовлена відмінностями між синовіальною рідиною та середовищем, в якому культивуються клітини. Лі та ін. (1997) культивували молоді бичачі хондроцити в агарозі, використовуючи поживне середовище, що містило DMEM, доповнене 20% телячої сироватки та великою кількістю нормальної алогенної синовіальної рідини. Присутність синовіальної рідини в середовищі індукувала збільшення кількості протеогліканів до 80% від загальної кількості синовіальної рідини. Ці результати вказують на те, що синовіальна рідина в культурі індукує рівень метаболізму, подібний до рівня in vivo, з високим рівнем синтезу глікозаміногліканів та низьким рівнем поділу клітин.
Г. Вербрюгген та ін. (1995) показали, що синтез 35S -arrpeKaHa людськими хондроцитами, культивованими в агарозі в безсироватковому DMEM, становив 20-30% від рівня синтезу, що спостерігався в DMEM, доповненому 10% телячої сироватки. Автори визначили ступінь, до якої IGF-1, IGF-2, TGF-R або інсулін відновлювали вироблення агреканів у безсироватковому середовищі. Автори дійшли висновку, що 100 нг/мл інсуліну, IGF-1 або IGF-2 частково відновлювали синтез агреканів до 39-53% від контрольного рівня. Синергізму чи кумуляції при поєднанні перерахованих факторів не спостерігалося. Водночас, 10 нг/мл TGF-R у присутності 100 нг/мл інсуліну стимулювали синтез агреканів до 90% або більше від контрольного рівня. Нарешті, трансферин сироватки людини, окремо або в поєднанні з інсуліном, не впливав на синтез агреканів. Коли телячу сироватку замінили на бичачий сироватковий альбумін, вміст агрегатів агреканів значно зменшився. Збагачення культурального середовища інсуліном, IGF або TGF-R частково відновило здатність клітин продукувати агрегати агреканів. Більше того, IGF-1 та інсулін здатні підтримувати гомеостаз у клітинних культурах. Після 40 днів культивування в середовищі, збагаченому 10-20 нг/мл IGF-1, синтез протеогліканів підтримувався на тому ж рівні або навіть вищому порівняно із середовищем, що містило 20% телячої сироватки. Катаболічні процеси протікали повільніше в середовищі, збагаченому IGF-1, ніж у середовищі, збагаченому 0,1% розчином альбуміну, але дещо швидше в середовищі, збагаченому 20% сироваткою. У довгоживучих культурах 20 нг/мл IGF-1 підтримує стабільний стан клітин.
Д. Лі та ін. (1993) порівнювали вплив складу середовища культивування (DMEM, DMEM+20% телячої сироватки, DMEM+20 нг/мл IGF-1) на синтез ДНК у культурі експлантату хрящової тканини, моношаровій культурі та в агарозній суспензії. При культивуванні в агарозі у присутності сироватки автори спостерігали тенденцію хондроцитів до групування у великі кластери. Клітини, культивовані без сироватки або з IGF-1, зберігали круглу форму в агарозі, збиралися в невеликі групи, але не утворювали великих агрегатів. У моношарі синтез ДНК був значно вищим у середовищі, що містить сироватку, ніж у середовищі, збагаченому IGF-1; синтез ДНК в останньому був значно вищим, ніж у незбагаченому середовищі. Не було виявлено відмінностей у синтезі ДНК при культивуванні хондроцитів в агарозній суспензії в незбагаченому середовищі та в середовищі з IGF-1. Водночас, культивування суспензій хондроцитів в агарозі в середовищі, збагаченому сироваткою, супроводжувалося підвищеним включенням радіонуклеотиду 3H -тимідину порівняно з іншими середовищами.
Вітамін С необхідний для активації ферментів, що беруть участь у формуванні стабільної спіральної структури колагенових фібрил. Хондроцити з дефіцитом аскорбінової кислоти синтезують недогідроксильовані неспіральні попередники колагену, які секретуються повільно. Введення аскорбінової кислоти (50 мкг/мл) викликає гідроксилювання колагену II та IX типів та їх секрецію в нормальних кількостях. Додавання вітаміну С не вплинуло на рівень синтезу протеогліканів. Отже, секреція колагену регулюється незалежно від секреції протеогліканів.

