Медичний експерт статті
Нові публікації
Серцеві клапани
Останній перегляд: 04.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Раніше вважалося, що всі серцеві клапани є простими структурами, внесок яких в односпрямований кровотік полягає лише в пасивному русі у відповідь на прикладений градієнт тиску. Таке розуміння «пасивних структур» призвело до розробки «пасивних» механічних та біологічних замінників клапанів.
Зараз стає очевидним, що клапани серця мають складнішу структуру та функції. Тому створення «активного» замінника клапана серця передбачає значну схожість за структурою та функціями з природним клапаном серця, що в майбутньому цілком реально завдяки розвитку тканинної інженерії.
Серцеві клапани розвиваються з ембріональних зачатків мезенхімальної тканини під час формування ендокарда. Під час морфогенезу формуються атріовентрикулярний канал (тристулковий та мітральний клапани серця) та вихідний тракт шлуночків (аортальний та легеневий клапани серця).
Як влаштовані клапани серця?
Вивчення кровопостачання клапанів було започатковано Н. Лушкою (1852), який ввів контрастну масу в судини серця. Він виявив численні кровоносні судини в стулках передсердно-шлуночкового та півмісяцевого клапанів аорти та легеневої артерії. Водночас у ряді посібників з патологічної анатомії та гістології містилися вказівки на те, що незмінені клапани серця людини не містять кровоносних судин, а останні з'являються в клапанах лише при різних патологічних процесах – атеросклерозі та ендокардиті різної етіології. Інформація про відсутність кровоносних судин базувалася переважно на гістологічних дослідженнях. Передбачалося, що за відсутності кровоносних судин у вільній частині стулок їх живлення відбувається шляхом фільтрації рідини з плазми крові, що омиває стулки. Відзначено проникнення кількох судин разом з волокнами поперечно-смугастої м'язової тканини в основи стулок та сухожильні хорди.
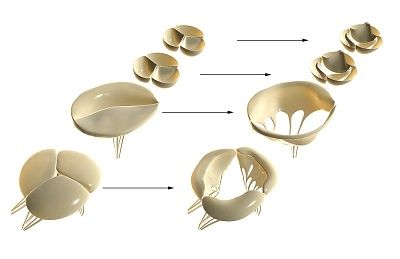
Однак, під час ін'єкції серцевих судин різними барвниками (туш у желатині, вісмут у желатині, водна суспензія чорного туші, розчини карміну або трипанового синього) було виявлено, що судини проникають крізь атріовентрикулярні клапани серця, аортальні клапани та легеневу артерію разом із тканиною серцевого м'яза, трохи не доходячи до вільного краю клапана.
У пухкій фіброзній сполучній тканині стулок атріовентрикулярного клапана виявлені окремі магістральні судини, що анастомозували з судинами в сусідніх ділянках поперечно-смугастої м'язової тканини серця.
Найбільша кількість кровоносних судин розташовувалася біля основи та порівняно менша — у вільній частині цих клапанів.
За даними К.І. Кульчицького та ін. (1990), у мітральному клапані виявлено більший діаметр артеріальних та венозних судин. Біля основи стулок цього клапана розташовані переважно магістральні судини з вузькопетлевою мережею капілярів, що проникають у базальну частину стулки та займають 10% її площі. У тристулковому клапані артеріальні судини мають менший діаметр, ніж у мітральному клапані. У стулках цього клапана розташовані переважно розсіяні судини та порівняно широкі петлі кровоносних капілярів. У мітральному клапані передня стулка інтенсивніше забезпечується кров’ю, у тристулковому клапані – передня та задня стулки, які виконують основну замикальну функцію. Співвідношення діаметрів артеріальних та венозних судин у атріовентрикулярних клапанах серця зрілих людей становить 1:1,5. Капілярні петлі мають полігональну форму та розташовані перпендикулярно до основи стулок клапана. Судини утворюють площинну мережу, розташовану під ендотелієм з боку передсердь. Кровоносні судини також знаходяться в сухожильних хордах, куди вони проникають з папілярних м'язів правого та лівого шлуночків на відстані до 30% довжини сухожильних хорд. Численні кровоносні судини утворюють дугоподібні петлі біля основи сухожильних хорд. Серцеві клапани аорти та легеневого стовбура суттєво відрізняються від передсердно-шлуночкових клапанів за кровопостачанням. Магістральні судини відносно меншого діаметра підходять до основи півмісяцевих стулок аорти та клапанів легеневого стовбура. Короткі гілки цих судин закінчуються капілярними петлями неправильної овальної та багатокутної форми. Вони розташовані переважно біля основи півмісяцевих стулок. Венозні судини біля основи аортального та легеневого клапанів також мають менший діаметр, ніж судини біля основи передсердно-шлуночкових клапанів. Співвідношення діаметрів артеріальних та венозних судин в аортальному та легеневому клапанах серця зрілих людей становить 1:1,4. Короткі бічні гілки відходять від більших судин, закінчуючись петлями капілярів неправильної овальної та багатокутної форми.

З віком відбувається огрубіння волокон сполучної тканини, як колагенових, так і еластичних, а також зменшення кількості пухкої фіброзної несформованої сполучної тканини, розвивається склероз тканини стулок атріовентрикулярного клапана та півмісяцевих стулок клапанів аортальної та легеневої артерій. Зменшується довжина поперечно-смугастих м'язових волокон серця в клапанах, а отже, зменшується їх кількість та кількість кровоносних судин, що пронизують клапани серця. Через ці зміни клапани серця втрачають свої еластичні та пружні властивості, що впливає на механізм закриття клапанів та гемодинаміку.
Серцеві клапани мають мережі лімфатичних капілярів та невелику кількість лімфатичних судин, забезпечених клапанами. Лімфатичні капіляри стулок мають характерний вигляд: їх просвіт дуже нерівномірний, один і той самий капіляр у різних ділянках має різний діаметр. У місцях злиття кількох капілярів утворюються розширення - лакуни різної форми. Петлі сіток часто неправильної багатокутної форми, рідше овальної або круглої. Часто петлі лімфатичних сіток не замкнуті, і лімфатичні капіляри закінчуються сліпо. Петлі лімфатичних капілярів орієнтовані найчастіше у напрямку від вільного краю стулки до її основи. У деяких випадках у стулках передсердно-шлуночкового клапана виявляли двошарову мережу лімфатичних капілярів.
Ендокардіальні нервові сплетення розташовані в різних його шарах, переважно під ендотелієм. На вільному краї стулок клапанів нервові волокна розташовані переважно радіально, з'єднуючись з волокнами сухожильних хорд. Ближче до основи стулок утворюється крупноячеисте нервове сплетення, яке з'єднується зі сплетенням, розташованим навколо фіброзних кілець. На півмісяцевих стулках ендокардіальна нервова мережа більш рідка. У місці прикріплення клапанів вона стає щільною та багатошаровою.
Клітинна структура серцевих клапанів
Клапанні інтерстиціальні клітини, що відповідають за підтримку структури клапана, мають видовжену форму з численними тонкими відростками, що простягаються по всій матриці клапана. Існує дві популяції клапанних інтерстиціальних клітин, які відрізняються морфологією та структурою; одна має скоротливі властивості та характеризується наявністю скоротливих фібрил, інша має секреторні властивості та має добре розвинений ендоплазматичний ретикулум і апарат Гольджі. Скоротлива функція протистоїть гемодинамічному тиску та додатково підтримується виробленням як серцевих, так і скелетних скоротливих білків, які включають важкі ланцюги альфа- та бета-міозину та різні ізоформи тропоніну. Скорочення стулки серцевого клапана було продемонстровано у відповідь на ряд вазоактивних агентів, що свідчить про скоординований біологічний стимул для успішного функціонування клапана.
Інтерстиціальні клітини також є важливими компонентами системи відновлення таких структур, як клапани серця. Постійний рух стулок клапана та пов'язана з ним деформація сполучної тканини призводять до пошкодження, на яке реагують інтерстиціальні клітини клапанів, щоб підтримувати цілісність клапана. Процес відновлення, здається, є життєво важливим для нормальної функції клапана, а відсутність цих клітин у сучасних моделях штучних клапанів, ймовірно, є фактором, що сприяє структурним пошкодженням біопротезів.
Важливою сферою досліджень інтерстиціальних клітин є вивчення взаємодій між ними та навколишнім матриксом, опосередкованих молекулами фокальної адгезії. Фокальні адгезії – це спеціалізовані сайти взаємодії клітини з матриксом, які пов'язують клітинний цитоскелет з білками матриксу через інтегрини. Вони також діють як сайти передачі сигналів, передаючи механічну інформацію з позаклітинного матриксу, яка може викликати реакції, включаючи, але не обмежуючись, клітинну адгезію, міграцію, ріст та диференціацію. Розуміння клітинної біології клапанних інтерстиціальних клітин є життєво важливим для з'ясування механізмів, за допомогою яких ці клітини взаємодіють одна з одною та з навколишнім середовищем, щоб цю функцію можна було відтворити в штучних клапанах.
У зв'язку з розвитком перспективного напрямку тканинної інженерії клапанів серця проводяться дослідження інтерстиціальних клітин з використанням широкого спектру методик. Наявність клітинного цитоскелету підтверджується фарбуванням на віментин, десмін, тропонін, альфа-актин та гладком'язовий міозин, важкі ланцюги альфа- та бета-міозину, легкі ланцюги-2 серцевого міозину, альфа- та бета-тубулін. Скоротливість клітин підтверджується позитивною відповіддю на адреналін, ангіотензин II, брадикінін, карбахол, хлорид калію, ендотелій I. Клітинні взаємозв'язки визначаються функціональними щілинними взаємодіями та перевіряються мікроін'єкціями карбоксифлуоресцеїну. Матриксна секреція встановлюється фарбуванням на проліл-4-гідроксилазу/колаген II типу, фібронектин, хондроїтинсульфат, ламінін. Іннервація встановлюється близьким розташуванням рухових нервових закінчень, що відображається активністю нейропептиду Y тирозингідроксилази, ацетилхолінестерази, вазоактивного кишкового поліпептиду, субстанції-P, пептиду, пов'язаного з геном стручкового перцю. Мітогенні фактори оцінюються за допомогою тромбоцитарного фактора росту, основного фактора росту фібробластів, серотоніну (5-HT). Досліджувані інтерстиціальні клітинні фібробласти характеризуються неповною базальною мембраною, довгими, тонкими цитоплазматичними відростками, тісним зв'язком з матриксом, добре розвиненим нерівномірним ендоплазматичним ретикулумом та апаратом Гольджі, багатством мікрофіламентів, утворенням адгезивних зв'язків.
Клапанні ендокардіальні клітини утворюють функціональну атромбогенну оболонку навколо кожного серцевого клапана, подібну до судинного ендотелію. Широко використовуваний метод заміни клапанів усуває захисну функцію ендокарда, що може призвести до відкладення тромбоцитів та фібрину на штучних клапанах, розвитку бактеріальної інфекції та кальцифікації тканин. Іншою ймовірною функцією цих клітин є регуляція підлеглих клапанних інтерстиціальних клітин, подібна до регуляції гладком'язових клітин ендотелієм. Між ендотелієм та сусідніми клітинами існують складні взаємодії, частково опосередковані розчинними факторами, що секретуються ендотеліальними клітинами. Ці клітини утворюють величезну поверхню, покриту мікровиступами з боку просвіту, тим самим збільшуючи експозицію та можливу взаємодію з метаболічними речовинами в циркулюючій крові.
Ендотелій часто демонструє морфологічні та функціональні відмінності, спричинені зсувними напругами на стінці судини внаслідок кровотоку, і це також стосується клапанних ендокардіальних клітин, які приймають або видовжену, або полігональну форму. Зміни в структурі клітин можуть виникати через дію локальної гемодинаміки на компоненти клітинного цитоскелету або вторинні ефекти, спричинені змінами в нижньому позаклітинному матриксі. На ультраструктурному рівні клапанні ендокардіальні клітини мають міжклітинні зв'язки, плазматичні везикули, шорсткий ендоплазматичний ретикулум та апарат Гольджі. Хоча вони виробляють фактор фон Віллебранда як in vivo, так і in vitro, їм бракує тілець Вейбеля-Паладе (специфічних гранул, що містять фактор фон Віллебранда), які є органелами, характерними для судинного ендотелію. Клапанні ендокардіальні клітини характеризуються міцними з'єднаннями, функціональними щілинними взаємодіями та перекриваючимися крайовими складками.
Ендокардіальні клітини зберігають свою метаболічну активність навіть in vitro: вони виробляють фактор фон Віллебранда, простациклін, синтазу оксиду азоту, демонструють активність ангіотензинперетворюючого ферменту та інтенсивно секретують молекули адгезії ICAM-1 та ELAM-1, які важливі для зв'язування мононуклеарних клітин під час розвитку імунної відповіді. Всі ці маркери слід враховувати при вирощуванні ідеальної клітинної культури для створення штучного клапана за допомогою тканинної інженерії, але імуностимулюючий потенціал самих клапанних ендокардіальних клітин може обмежувати їх використання.
Позаклітинний матрикс серцевих клапанів складається з фіброзних макромолекул колагену та еластину, протеогліканів та глікопротеїнів. Колаген становить 60% сухої ваги клапана, еластин – 10%, а протеоглікани – 20%. Колагеновий компонент забезпечує основну механічну стабільність клапана та представлений колагенами типів I (74%), II (24%) та V (2%). Пучки колагенових ниток оточені еластиновою оболонкою, яка опосередковує взаємодії між ними. Бічні ланцюги глікозаміногліканів молекул протеогліканів прагнуть утворювати гелеподібну речовину, в якій інші молекули матриксу взаємодіють, утворюючи постійні зв'язки, а інші компоненти відкладаються. Глікозаміноглікани серцевих клапанів людини складаються переважно з гіалуронової кислоти, меншою мірою з дерматансульфату, хондроїтин-4-сульфату та хондроїтин-6-сульфату, з мінімальною кількістю гепарансульфату. Ремоделювання та оновлення матриксної тканини регулюються матриксними металопротеїназами (ММП) та їх тканинними інгібіторами (ТІ). Ці молекули також беруть участь у ширшому спектрі фізіологічних та патологічних процесів. Деякі металопротеїнази, включаючи інтерстиціальні колагенази (MMP-1, MMP-13) та желатинази (MMP-2, MMP-9) та їх тканинні інгібітори (TI-1, TI-2, TI-3), виявлені у всіх клапанах серця. Надмірне вироблення металопротеїназ характерне для патологічних станів клапанів серця.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Серцеві клапани та їх морфологічна будова
Серцеві клапани складаються з трьох морфологічно різних та функціонально значущих шарів матриксу стулок: фіброзного, губчастого та шлуночкового.
Фіброзний шар утворює стійкий до навантаження каркас для стулки клапана, що складається з шарів колагенових волокон. Ці волокна розташовані радіально в складках, що дозволяє артеріальним клапанам розтягуватися під час закриття. Фіброзний шар лежить поблизу вихідної зовнішньої поверхні цих клапанів. Фіброзний шар атріовентрикулярних клапанів служить продовженням колагенових пучків сухожильних хорд. Він розташований між губчастим (вхідним) та шлуночковим (вихідним) шарами.
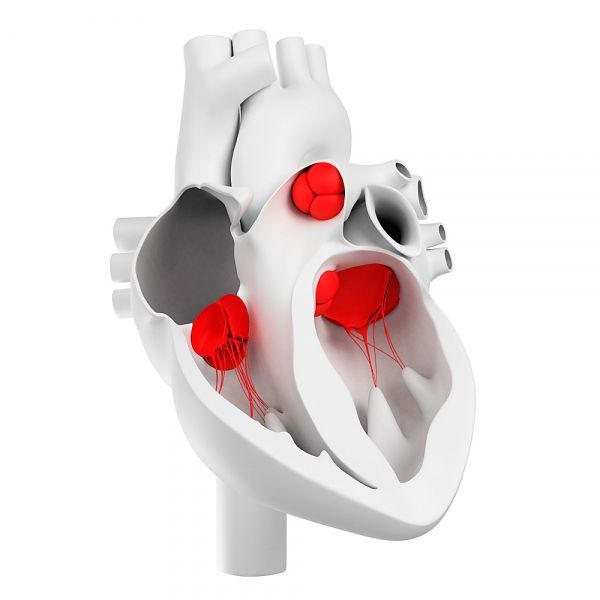
Між фіброзним і шлуночковим шарами розташований губчастий шар (spongiosa). Губчастий шар складається з погано організованої сполучної тканини у в'язкому середовищі. Домінуючими компонентами матриксу цього шару є протеоглікани з хаотично орієнтованим колагеном і тонкими шарами еластину. Бічні ланцюги молекул протеогліканів несуть сильний негативний заряд, що впливає на їх високу здатність зв'язувати воду та утворювати пористий матриксний гель. Губчастий шар матриксу зменшує механічне напруження в стулках серцевого клапана та підтримує їхню гнучкість.
Шлуночковий шар значно тонший за інші та багатий на еластичні волокна, що дозволяють тканині чинити опір постійній деформації. Еластин має губчасту структуру, що оточує та з'єднує колагенові волокна, і підтримує їх у нейтральному складеному стані. Вхідний шар клапана (шлуночковий - для артеріальних клапанів та губчастий - для атріовентрикулярних) містить більше еластину, ніж вихідний, що забезпечує пом'якшення гідравлічного удару при закритті стулок. Такий взаємозв'язок між колагеном та еластином дозволяє стулкам розтягуватися до 40% без стабільної деформації. При впливі невеликого навантаження колагенові структури цього шару орієнтуються в напрямку навантаження, і його опір подальшому зростанню навантаження зростає.
Таким чином, уявлення про клапани серця як про прості ендокардіальні дуплікації не тільки спрощене, але й по суті неправильне. Клапани серця – це складні органи, що включають поперечно-смугасті м’язові волокна, кровоносні та лімфатичні судини, а також нервові елементи. Як за своєю структурою, так і за своїм функціонуванням клапани є невід’ємною частиною всіх серцевих структур. Аналіз нормальної функції клапана повинен враховувати його клітинну організацію, а також взаємодію клітин одна з одною та з матриксом. Знання, отримані в результаті таких досліджень, є провідними в проектуванні та розробці клапанних протезів з використанням тканинної інженерії.

