Медичний експерт статті
Нові публікації
Діагностика стадій перебігу раку передміхурової залози
Останній перегляд: 04.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Клінічно розрізняють локалізований (T1-2 , N0 , M0 ), місцево-поширений (T3-4 , N0-1 , M0 ) та генералізований рак (T1-4 , N0-1 , M1 ).
Пацієнти з клінічно локалізованою та місцево-поширеною стадіями класифікуються за ступенем ризику (D'Amico A V. et al., 2003):
- низький: стадія T 1a-c; рівень ПСА менше 10 мкг/мл: шкала Глісона - 2-5; при біопсії - одностороннє ураження менше 50%:
- помірний: стадія T2a ; рівень ПСА менше 10 нг/мл; бал за шкалою Глісона - 3 + 4 = 7; при біопсії - двостороннє ураження менше 50%;
- висока стадія T2b , T3a -b; рівень ПСА - 10-20 нг/мл; шкала Глісона - більше 4 + 3 - 7; при біопсії - пошкодження більше 50%, периневральна інвазія;
- дуже високий: стадія T4 ; рівень ПСА понад 20 нг/мл; бал за шкалою Глісона понад 8; біопсія показує лімфоваскулярну інвазію.
Після уточнення діагнозу та встановлення ступеня ураження процесу (локалізований, місцево-поширений чи генералізований) лікар і пацієнт стикаються з вибором методу лікування. У сучасному суспільстві велике значення надається якості життя пацієнтів після початку лікування. Якість життя без лікування відповідає перебігу основного захворювання та залежить від прогресування онкологічного процесу. Зміни якості життя відбуваються переважно після початку лікування та застосування одного з терапевтичних або хірургічних методів. Чітке встановлення стадії процесу дозволяє не тільки вибрати оптимальний метод лікування, але й передбачити подальший перебіг захворювання.
Визначення рівня ПСА в поєднанні з клінічною картиною раку передміхурової залози та градацією пухлини за шкалою Глісона значно підвищує інформативність кожного з перелічених показників у встановленні патологічної стадії раку. А. В. Партін та ін. (1997) запропонували прогностичні таблиці, що дозволяють прогнозувати подальше поширення пухлини, вибір методу лікування, ступінь радикальності та прогноз ефективності лікування.
Для оцінки поширення пухлини найчастіше використовуються такі методи, як ДРЕ, ТРУЗІ, визначення рівня ПСА та сцинтиграфія кісток. За необхідності призначається комп'ютерна томографія (КТ) або магнітно-резонансна томографія (МРТ) та рентген грудної клітки.
Будь-який з методів візуалізації призначений для визначення стадії та оцінки ефективності лікування. Після верифікації діагнозу уролог повинен уточнити об'єм первинної пухлини, її межі, інвазивний чи метастатичний потенціал пухлини. Всі ці показники мають велике значення для прогнозу захворювання та вибору методу лікування.
Первинна пухлина (Т)
Перш за все, необхідно визначити, чи пухлина обмежується передміхуровою залозою (T 1-2 ), чи виходить за межі капсули (T 3-4 ). Пальцеве дослідження часто не дозволяє оцінити поширення пухлини. За деякими даними, результати ДРЕ відповідають результатам гістологічного дослідження менш ніж у 50% пацієнтів. Однак більш детальне обстеження показано лише при вирішенні питання про радикальне лікування.
Рівень ПСА може відображати поширеність пухлини, але не дозволяє точно визначити морфологічну стадію. Поєднання рівня ПСА, індексу Глісона та даних пальпації дозволяє краще передбачити морфологічну стадію, ніж кожен із цих параметрів окремо. Значення вільного ПСА є суперечливим: в одному дослідженні визначення вмісту вільного ПСА допомогло уточнити стадію локалізованих пухлин, але інші дослідження цього не підтвердили. Тільки поглиблені дослідження допоможуть вирішити це питання.
Трансректальне ультразвукове дослідження найчастіше використовується для дослідження стану передміхурової залози. Цей метод може виявити лише 60% пухлин і не завжди показує інвазію капсули. Майже у 60% пацієнтів спостерігається стадія Т3 . Ультразвукове дослідження вказує на менш поширений процес. Ультразвуковими ознаками інвазії капсули є випинання, нерівність та розрив контуру залози. Інвазія пухлинних клітин у сім'яні міхурці є поганою прогностичною ознакою, але інформація про неї надзвичайно важлива для вибору методу лікування. При проведенні ТРУЗІ слід звертати увагу на ехоструктуру везикул (гіперехогенність), їх асиметрію, деформацію та розширення. Також на пошкодження сім'яних міхурців вказує втрата округлості та ущільнення біля основи залози. Ці ознаки досить суб'єктивні, тому недоцільно повністю покладатися на дані ультразвукового дослідження. Інвазія сім'яних міхурців вказує на високий ризик локального рецидиву та метастазів, і для уточнення (перед операцією) показана їх біопсія. Обстеження не слід починати з цієї процедури, але якщо ризик інвазії високий і вибір лікування залежить від результату біопсії, то її проведення виправдане. Негативний результат не виключає мікроскопічної інвазії. Як правило, біопсія сім'яних міхурців проводиться на клінічній стадії T 2b і вище та вмісті ПСА більше 10 нг/мл. Результат вважається позитивним, якщо хоча б одна біопсія з основи передміхурової залози містить пухлинні клітини. Не тільки додаткові дослідження, але й ретельний аналіз результатів первинної біопсії дозволяють підвищити точність клінічного визначення стадії (відіграють роль кількість і поширеність пухлинних вогнищ, інвазія капсули). Важливий також ступінь диференціації: при індексі Глісона менше 6 пухлина локалізована у 70% випадків.
Кровотік у передміхуровій залозі при раку вищий, ніж у нормальній залозі або при її гіперплазії. Після кастрації інтенсивність кровотоку в залозі знижується. Розробка ехо-доплерографічних карт для діагностики та моніторингу раку передміхурової залози є перспективною, але наразі немає достовірних даних щодо використання ехо-доплерографії у визначенні стадії локального процесу. Можливе використання цього методу для отримання додаткового матеріалу під час цілеспрямованої біопсії з вогнищ патологічної васкуляризації.
Результати візуалізації раку простати безпосередньо залежать від технічного оснащення клініки та досвіду спеціаліста. Саме тому всі сучасні методи візуалізації відіграють не визначальну, а уточнюючу роль, а вибір методу лікування базується на поєднанні даних клінічного обстеження та інструментальних досліджень.
МРТ має найкращі можливості для візуалізації структури передміхурової залози. Сучасним стандартом дослідження органів малого тазу методом МРТ є використання ендоректального датчика, який дозволяє отримати зображення з максимально можливою просторовою роздільною здатністю 0,5-1 мм. Нагнітання повітря в ендоректальний датчик забезпечує чітку візуалізацію капсули передміхурової залози, ректопростатичних кутів та ректопростатичної фасції Денонвільє. Використання ендоректального датчика в МРТ не обмежує візуалізацію регіонарних лімфатичних вузлів (до рівня біфуркації черевної аорти). Рак передміхурової залози характеризується низькою інтенсивністю сигналу на Т-зважених зображеннях на тлі високоінтенсивного сигналу від незміненої периферичної зони залози. Неправильна форма, дифузне поширення з мас-ефектом, розмиті та нерівні контури є морфологічними характеристиками вогнищ низької інтенсивності сигналу в периферичній зоні передміхурової залози, що свідчить про неопластичний характер ураження. При проведенні динамічного контрастування ракові вогнища швидко накопичують контрастну речовину в артеріальній фазі та швидко виводять її, що відображає ступінь ангіогенезу та, відповідно, ступінь злоякісності пухлини. Низька інтенсивність сигналу також характерна для вогнищ постбіопсійних крововиливів, простатиту, стромальної доброякісної гіперплазії нейтральної зони залози, фіброзно-рубцевих змін, фібром'язової гіперплазії, наслідків гормональної або променевої терапії. МРТ без динамічного контрастування не дозволяє достовірно диференціювати більшість перелічених змін та захворювань.
Як зазначалося вище, одним з основних завдань будь-якого методу візуалізації раку передміхурової залози є визначення об'єму ураження залози та поширення пухлини за межі капсули. Визначення об'єму пухлини має важливе значення для прогнозу. Об'єм пухлини менше 4 см3 свідчить про віддалені метастази, а 12 см3 – про надзвичайно високу ймовірність метастазів. Згідно з дослідженнями, точність МРТ у виявленні вогнищ неопластичних уражень передміхурової залози коливається від 50 до 90%. Чутливість МРТ у визначенні локалізації раку передміхурової залози становить близько 70-80%, тоді як мікроскопічні вогнища раку (фокуси) неможливо виявити за допомогою МРТ.
Найважливішою перевагою ендоректальної МРТ є здатність локалізувати неопластичні ураження в ділянках, недоступних для інших діагностичних методів, та уточнити характер і напрямок росту пухлини. Наприклад, МРТ дозволяє виявляти неопластичні ураження в передніх відділах периферичної зони передміхурової залози, недоступних за допомогою трансректальної біопсії. Загалом, МРТ суттєво доповнює дані ДРЕ та ТРУЗІ щодо локалізації пухлини.
Ендоректальна МРТ дозволяє візуалізувати капсулу залози, судинно-нервові пучки, сім'яні міхурці, верхівку залози, перипростатичне венозне сплетення та визначити локальну поширеність пухлини залози. Слід наголосити, що проникнення капсули вважається мікроскопічною ознакою, і навіть сучасні апарати МРТ (ендоректальна котушка) не здатні надати таку інформацію. Можливо отримати лише дані про ріст за межі капсули залози.
Діагностичні критерії екстракапсулярного поширення за даними МРТ:
- наявність екстракапсулярної пухлини;
- нерівний контур залози (деформація, незграбність);
- асиметрія судинно-нервових пучків;
- облітерація ректопростатичних кутів;
- широкий контакт пухлини з капсулою.
Найвища специфічність (до 95-98%) та точність результатів МРТ досягаються при обстеженні пацієнтів із середнім або високим ризиком екстракапсулярної інвазії. Вважається, що екстракапсулярна інвазія (за даними МРТ) свідчить про недоцільність хірургічного лікування та несприятливий прогноз перебігу захворювання. Гормональна або променева терапія не впливає на точність виявлення екстракапсулярного поширення пухлини простати. Основною складністю у виявленні вогнищ раку та екстракапсулярного поширення пухлини є висока варіабельність інтерпретації томограм різними спеціалістами. Першочерговим завданням спеціаліста з променевої діагностики є досягнення високої діагностичної специфічності (навіть на шкоду чутливості), щоб не позбавляти операбельних пацієнтів можливості радикального лікування.
Подібність щільності ракової, гіперпластичної та нормальної тканини простати на КТ робить цей метод малокорисним для оцінки локального поширення пухлини. Інвазія в сім'яні міхурці є важливішою, ніж інвазія в капсули, але навіть у цьому випадку КТ надає інформацію лише в запущених випадках. Однак цей метод активно використовується для позначення зони ураження перед променевою терапією.
Повільний розвиток променевої діагностики в нашій країні призвів до пізньої діагностики раку передміхурової залози та, як наслідок, до недостатньої поширеності радикальних методів лікування раку передміхурової залози (наприклад, простатектомії), низької доступності сучасних томографів та відсутності відповідних навчальних програм для спеціалістів з променевої діагностики та урологів. Незважаючи на те, що КТ та МРТ зараз широко поширені, рівень оснащення кабінетів та освіти спеціалістів з променевої діагностики є недостатнім для того, щоб отримана інформація стала вирішальною у виборі методу лікування пацієнтів з раком передміхурової залози.
Регіонарні лімфатичні вузли (N)
Регіонарні лімфатичні вузли слід оцінювати лише тоді, коли це безпосередньо впливає на стратегію лікування (зазвичай під час планування радикального лікування). Високий рівень ПСА, пухлини T2c -T3a, погана диференціація та периневральна інвазія пов'язані з високим ризиком метастазування в лімфатичні вузли. Оцінка стану лімфатичних вузлів на основі рівнів ПСА вважається недостатньою.
Тільки лімфаденектомія (відкрита або лапароскопічна) надає необхідну інформацію. Недавні дослідження розширеної лімфаденектомії показали, що рак передміхурової залози не завжди вражає обтураторні лімфатичні вузли. При безсимптомних пухлинах та рівні ПСА менше 20 кг/мл. КТ підтверджує збільшені лімфатичні вузли лише в 1% випадків. Застосування МРТ або КТ виправдане у випадках високого ризику метастазування, оскільки специфічність цих методів досягає 93-96%. Однак навіть позитивний результат при їх використанні може бути хибним, і лише пункція підозрілого лімфатичного вузла дозволяє відмовитися від лімфаденектомії. Згідно з ретроспективним аналізом, розмір лімфатичного вузла не завжди свідчить про наявність у ньому метастазів; асиметрія уражених лімфатичних вузлів вважається більш інформативною ознакою. Наразі лише у 2-3% пацієнтів, які перенесли радикальну простатектомію з приводу локалізованого раку передміхурової залози, діагностують метастази в лімфатичні вузли на основі післяопераційного гістологічного дослідження.
Позитронно-емісійна томографія (ПЕТ) та сцинтиграфія з міченими антитілами рекомендуються як методи виявлення метастазів у лімфатичні вузли, але їх використання все ще обмежене через недостатню чутливість.
Номограми Партіна (2001) можуть бути використані для оцінки ризику ураження регіональних лімфатичних вузлів. Номограми – це математичні алгоритми, що використовуються для конкретного пацієнта або групи пацієнтів. Ці таблиці дозволяють визначити ймовірність локального поширення пухлини (на капсулу, сім'яні міхурці) та ураження лімфатичних вузлів на основі клінічної стадії, рівня ПСА та індексу Глісона. Зокрема, вони дають змогу виділити групу пацієнтів з низькою (менше 10%) ймовірністю метастазування в лімфатичні вузли (з рівнем ПСА понад 20 нг/мд, стадією T 1-2a та індексом Глісона 2-6); у цій групі стан лімфатичних вузлів може бути не уточнений до радикального лікування. Ризик метастазування в лімфатичні вузли також можна оцінити шляхом виявлення ділянок пухлини з вираженою анаплазією (4-5 балів): якщо такі ділянки виявлені в чотирьох або більше біопсіях або вони переважають хоча б в одній біопсії, ризик досягає 20-45%. В інших пацієнтів він не перевищує 2,5%. Додаткове обстеження в таких випадках не потрібне.
Віддалені метастази (М)
У 85% пацієнтів, які помирають від раку передміхурової залози, виявляються ураження осьового скелета. Метастази в кістках виникають внаслідок проникнення ракових клітин у кістковий мозок з кровотоком, що призводить до росту пухлини та лізису кісткових структур. Поширеність метастазів у кістках впливає на прогноз, а їх раннє виявлення попереджає лікаря про можливі ускладнення. У 70% випадків метастазування поєднується з підвищенням активності кісткового ізоферменту лужної фосфатази (ЛФ). Визначення активності ЛФ та рівня ПСА у переважній більшості випадків дозволяє виявити метастази в кістках. Згідно з багатовимірним аналізом, на ці показники впливає лише кількість метастазів у кістках. Важливо, що активність кісткового ізоферменту ЛФ точніше відображає ступінь пошкодження кісток, ніж рівень ПСА.
Сцинтиграфія вважається найчутливішим методом виявлення метастазів у кістках (вона перевершує рентгенографію та визначення активності лужної та кислої фосфатази). Дифосфонати технецію краще використовувати як радіофармацевтичний препарат, оскільки їх накопичення в кістках відбувається набагато активніше, ніж у м’яких тканинах. Показано кореляцію між напівкількісною оцінкою пошкодження кісток та виживанням. Виявлення віддалених метастазів можливе в будь-якому органі. Найчастіше вони виникають у нерегіонарних лімфатичних вузлах, легенях, печінці, головному мозку та шкірі. У разі відповідних скарг та симптомів для їх виявлення використовується рентгенографія грудної клітки, УЗД, КТ та МРТ. Тактика при підозрі на метастази в кістках представлена на схемі.
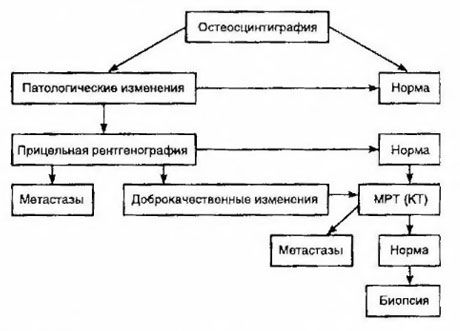
Найнадійнішим лабораторним показником, який допомагає визначити ступінь метастазування, є рівень ПСА. Показано, що його підвищення понад 100 нг/мл є єдиним параметром, який достовірно вказує на віддалені метастази. Визначення рівня ПСА зменшує кількість пацієнтів, яким потрібна сцинтиграфія кісток. Ймовірність виявлення метастазів у кістках при зниженні рівня ПСА дуже низька. За відсутності скарг та початкового вмісту ПСА менше 20 нг/мл, виявлення високо- та помірно диференційованих пухлин, сцинтиграфії можна уникнути. Водночас, у разі низькодиференційованих пухлин та інвазії капсули показана сцинтиграфія (незалежно від рівня ПСА).


 [
[