Медичний експерт статті
Нові публікації
Лікування тяжкого сепсису та септичного шоку
Останній перегляд: 04.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
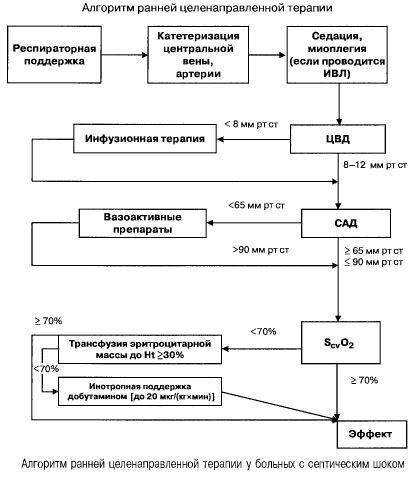
Ефективне лікування сепсису можливе лише за умови повної хірургічної санації вогнища інфекції та адекватної антимікробної терапії. Неадекватна початкова антимікробна терапія є фактором ризику смерті у пацієнтів із сепсисом. Підтримка життя пацієнта, запобігання та усунення порушень функції органів можливі лише за умови цілеспрямованої інтенсивної терапії.
Його головна мета — оптимізація транспорту O2 за умов його підвищеного споживання, що характерно для тяжкого сепсису та септичного шоку. Це лікування реалізується шляхом гемодинамічної та респіраторної підтримки.
Гемодинамічна підтримка
Інфузійна терапія
Інфузійна терапія є одним із початкових заходів для підтримки гемодинаміки та, перш за все, серцевого викиду. Її основними завданнями у пацієнтів із сепсисом є:
- відновлення адекватної тканинної перфузії,
- корекція порушень гомеостазу,
- нормалізація клітинного метаболізму,
- зниження концентрації медіаторів септичного каскаду та токсичних метаболітів.
При сепсисі з поліорганною недостатністю та септичним шоком намагаються швидко (протягом перших 6 годин) досягти таких значень важливих показників:
- гематокрит >30%,
- діурез 0,5 мл/(кг/год),
- сатурація крові у верхній порожнистій вені або правому передсерді >70%,
- середній артеріальний тиск >65 мм рт. ст.,
- ЦВТ 8-12 мм рт. ст.
Підтримка цих значень на заданому рівні покращує виживаність пацієнтів (категорія доказів B). Гемодинамічний моніторинг за допомогою катетера Свана-Ганца та технології PICCO (транспульмональна термодилюція та аналіз пульсової хвилі) розширюють можливості моніторингу та оцінки ефективності гемодинамічної терапії, але немає доказів того, що вони покращують виживаність.
Оптимальне значення переднавантаження підбирається індивідуально, оскільки необхідно враховувати ступінь пошкодження ендотелію та стан лімфатичного дренажу в легенях, діастолічну функцію шлуночків, зміни внутрішньогрудного тиску. Об'єм інфузійної терапії підбирається таким чином, щоб ПВНП не перевищувала плазмову КОП (профілактика ОЛ) та відбувалося збільшення СО. Додатково враховуються параметри, що характеризують газообмінну функцію легень (paO2 та paO2 / FiO2 ), та зміни рентгенологічної картини.
Для інфузійної терапії в рамках цілеспрямованого лікування сепсису та септичного шоку використовуються кристалоїдні та колоїдні розчини з практично однаковими результатами.
Усі інфузійні середовища мають як переваги, так і недоліки. Сьогодні, враховуючи результати експериментальних та клінічних досліджень, немає підстав надавати перевагу якомусь конкретному типу.
- Наприклад, для адекватної корекції венозного повернення та рівня переднавантаження необхідно вводити об'єм кристалоїдів, у 2-4 рази більший, ніж колоїдів, що пов'язано з особливостями розподілу розчину в організмі. Крім того, інфузія кристалоїдів пов'язана з більшим ризиком набряку тканин, а їх гемодинамічний ефект коротший, ніж у колоїдів. Водночас кристалоїди дешевші, не впливають на коагуляційний потенціал та не провокують анафілактоїдні реакції. Виходячи з вищезазначеного, якісний склад інфузійної програми визначається залежно від особливостей пацієнта, враховуючи ступінь гіповолемії, фазу ДВЗ-синдрому, наявність периферичних набряків та концентрацію альбуміну в сироватці крові, тяжкість гострого ураження легень.
- Плазмозамінники (декстрани, желатинові препарати, гідроксиетилкрохмаль) показані у випадках тяжкого дефіциту базальноклітинної клітини (ОЦК). Гідроксиетилкрохмалі зі ступенем заміщення 200/0,5, 130/0,4 та 130/0,42 мають потенційну перевагу над декстранами завдяки меншому ризику виходу через мембрану та відсутності клінічно значущого впливу на гемостаз.
- Введення альбуміну в критичних станах може збільшити ризик смерті. Збільшення КОП під час його інфузії є тимчасовим, а потім, за умов підвищеної проникності капілярного русла (синдром «капілярної витоку»), відбувається подальша екстравазація альбуміну. Можливо, що переливання альбуміну буде корисним лише за умови, що його концентрація в сироватці крові менше 20 г/л і немає ознак «витоку» в інтерстицій.
- Застосування кріоплазми показано при коагулопатії споживання та зниженому коагуляційному потенціалі крові.
- Широке використання донорської еритроцитарної маси має бути обмежене через високий ризик розвитку різних ускладнень (ГПЛ, анафілактичні реакції тощо). На думку більшості експертів, мінімальна концентрація гемоглобіну у пацієнтів з тяжким сепсисом становить 90-100 г/л.
Корекція гіпотензії
Низький перфузійний тиск вимагає негайної активації препаратів, що підвищують судинний тонус та/або інотропну функцію серця. Дофамін або норадреналін є препаратами першої лінії для корекції гіпотензії у пацієнтів із септичним шоком.
Дофамін (допмін) у дозі <10 мкг/(кг х хв) підвищує артеріальний тиск, головним чином шляхом збільшення CO, та має мінімальний вплив на системний судинний опір. У високих дозах переважає його α-адренергічний ефект, що призводить до артеріальної вазоконстрикції, а в дозі <5 мкг/(кг х хв) дофамін стимулює дофамінергічні рецептори ниркових, брижових та коронарних судин, що призводить до вазодилатації, посилення клубочкової фільтрації та екскреції Na+.
Норадреналін підвищує середній артеріальний тиск і збільшує клубочкову фільтрацію. Оптимізація системної гемодинаміки під його дією призводить до покращення функції нирок без застосування низьких доз дофаміну. Дослідження останніх років показали, що його ізольоване застосування, порівняно з комбінацією з високими дозами дофаміну, призводить до статистично значущого зниження смертності.
Адреналін – це адренергічний препарат з найбільш вираженими гемодинамічними побічними ефектами. Він має дозозалежний вплив на частоту серцевих скорочень, середній артеріальний тиск, серцевий викид, функцію лівого шлуночка, а також доставку та споживання O2 . Однак одночасно виникають тахіаритмії, погіршення кровотоку в органах та гіперлактатемія. Тому застосування адреналіну обмежується випадками повної рефрактерності до інших катехоламінів.
Добутамін є препаратом вибору для збільшення доставки та споживання CO та O2 при нормальному або підвищеному переднавантаженні. Завдяки своїй переважної дії на бета1-адренергічні рецептори, він ефективніше, ніж дофамін, підвищує ці параметри.
Експериментальні дослідження показали, що катехоламіни, окрім підтримки кровообігу, можуть регулювати перебіг системного запалення, впливаючи на синтез ключових медіаторів з віддаленим ефектом. Під впливом адреналіну, дофаміну, норадреналіну та добутаміну активовані макрофаги знижують синтез та секрецію TNF-α.
Підбір адренергічних засобів здійснюється за наступним алгоритмом:
- серцевий індекс 3,5-4 л/(хв x м² ), SvO² > 70% - дофамін або норадреналін,
- серцевий індекс <3,5 л/(хв x м² ), SvO² < 70% - добутамін (якщо систолічний артеріальний тиск <70 мм рт. ст. - разом з норадреналіном або дофаміном).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Дихальна підтримка
Легені є одними з перших органів-мішеней, що залучаються до патологічного процесу при сепсисі. Гостра дихальна недостатність є одним з провідних компонентів поліорганної дисфункції. Її клінічні та лабораторні прояви при сепсисі відповідають ГДН, а при прогресуванні патологічного процесу - ГРДС. Показання до штучної вентиляції легень при тяжкому сепсисі визначаються залежно від тяжкості паренхіматозної дихальної недостатності (ГДН або ГРДС). Її критерієм є дихальний індекс:
- <200 – показана інтубація трахеї та респіраторна підтримка,
- >200 – показники визначаються індивідуально.
Якщо пацієнт перебуває у свідомості під час самостійного дихання з кисневою підтримкою, немає високих витрат на роботу дихання та вираженої тахікардії (ЧСС <120 за хвилину), нормальне значення венозного повернення SO2 > 90%, то можна утриматися від переведення його на штучну вентиляцію легень. Однак необхідно ретельно контролювати стан пацієнта. Оптимальне значення SO2 становить близько 90%. Його можна підтримувати різними методами подачі газу (лицьові маски, носові катетери) у нетоксичних концентраціях (FiO2 < 0,6). Неінвазивна штучна вентиляція легень протипоказана при сепсисі (категорія доказів B).
Слід уникати режимів штучної вентиляції легень з високим об’ємом (ШВЛ) (VO2 = 12 мл/кг), оскільки в таких випадках посилюється секреція цитокінів легенями, що призводить до посилення ШВЛ. Необхідно дотримуватися концепції безпечної ШВЛ, яка можлива за умови виконання наступних умов (категорія доказів А):
- розчиненого вуглецю <10 мл/кг,
- неінвертоване співвідношення вдиху та видиху,
- піковий тиск у дихальних шляхах <35 см H2O,
- FiO2 <0,6 .
Підбір параметрів дихального циклу здійснюється до досягнення адекватної штучної вентиляції легень, її критерії: paO2 > 60 мм рт. ст., SpO2 > 88-93%, pvO2 35-45 мм рт. ст., SvO2 > 55%.
Одним з ефективних методів оптимізації газообміну є проведення штучної вентиляції легень у положенні лежачи на животі (Prone Positioning) (категорія доказів B). Це положення ефективне у пацієнтів у найважчому стані, хоча його вплив на зниження смертності у довгостроковому періоді статистично незначущий.
Харчова підтримка
Проведення штучної нутритивної підтримки є важливим елементом лікування, одним з обов'язкових заходів, оскільки розвиток синдрому поліорганної недостатності при сепсисі зазвичай супроводжується проявами гіперметаболізму. У такій ситуації енергетичні потреби задовольняються за рахунок руйнування власних клітинних структур (аутоканібалізм), що посилює дисфункцію органів та посилює ендотоксикоз.
Харчова підтримка розглядається як метод профілактики тяжкого виснаження (білково-енергетичної недостатності) на тлі вираженого підвищення ката- та метаболізму. Включення ентерального харчування до комплексу інтенсивної терапії запобігає переміщенню кишкової мікрофлори, дисбактеріозу, підвищує функціональну активність ентероцитів та захисні властивості слизової оболонки кишечника. Ці фактори знижують ступінь ендотоксикозу та ризик вторинних інфекційних ускладнень.
Розрахунок нутритивної підтримки:
- енергетична цінність - 25-35 ккал/(кг маси тіла х добу),
- кількість білка - 1,3-2,0 г/(кг маси тіла х добу),
- кількість вуглеводів (глюкози) - менше 6 г/кг/день,
- кількість жиру - 0,5-1 г/кг/день,
- глутаміндипептиди 0,3-0,4 г/кг/день,
- вітаміни - стандартний добовий набір + вітамін K (10 мг/день) + вітаміни B1 та B6 ( 100 мг/день) + вітаміни A, C, E,
- мікроелементи - стандартна добова норма + Zn (15-20 мг/день + 10 мг/день за наявності рідкого стільця),
- електроліти - Na+, K+, Ca2+ згідно з балансовими розрахунками та концентрація у плазмі.
Ранній початок нутритивної підтримки (24-36 год) є ефективнішим, ніж на 3-4-й день інтенсивної терапії (категорія доказів B), особливо при ентеральному зондовому харчуванні.
При тяжкому сепсисі переваги ентерального чи парентерального харчування відсутні; тривалість порушення функції органів та тривалість респіраторної та інотропної підтримки однакові, а показники смертності однакові. Враховуючи вищезазначене, раннє ентеральне харчування є дешевшою альтернативою парентеральному харчуванню. Використання сумішей, збагачених харчовими волокнами (пребіотиками), для зондового харчування значно знижує частоту діареї у пацієнтів з тяжким сепсисом.
Для ефективного синтезу білка в організмі важливо підтримувати метаболічне співвідношення «загальний азот, г - небілкові калорії, ккал» = 1-(110-130). Максимальна доза вуглеводів становить 6 г / (кг маси тіла на добу), оскільки введення великих доз загрожує гіперглікемією та активацією катаболізму в скелетних м'язах. Жирові емульсії рекомендується вводити цілодобово.
Протипоказання до нутритивної підтримки:
- декомпенсований метаболічний ацидоз,
- індивідуальна непереносимість допоміжних поживних речовин,
- тяжка невідновлена гіповолемія,
- рефрактерний шок - доза дофаміну >15 мкг/(кг х хв) та систолічний артеріальний тиск <90 мм рт. ст.,
- тяжка непіддатлива лікуванню артеріальна гіпоксемія.
Глікемічний контроль
Важливим аспектом комплексного лікування тяжкого сепсису є постійний моніторинг концентрації глюкози в плазмі крові та інсулінотерапія. Висока глікемія та необхідність її корекції є факторами несприятливого результату при сепсисі. Враховуючи вищезазначені обставини, у пацієнтів підтримується нормоглікемія (4,5-6,1 ммоль/л), для чого при підвищенні концентрації глюкози вище допустимих значень проводиться інфузія інсуліну (0,5-1 Од/год). Залежно від клінічної ситуації, концентрація глюкози контролюється кожні 1-4 години. При реалізації цього алгоритму відзначено статистично значуще збільшення виживання пацієнтів.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Глюкокортикоїди
Результати сучасних досліджень щодо ефективності застосування глюкокортикоїдів у пацієнтів із септичним шоком узагальнено в наступних твердженнях:
- недоцільно використовувати гормони у високих дозах [метилпреднізолон 30-120 мг/(кг х добу) одноразово або протягом 9 днів, дексаметазон 2 мг/(кг х добу) протягом 2 днів, бетаметазон 1 мг/(кг х добу) протягом 3 днів] – підвищений ризик внутрішньолікарняних інфекцій, відсутність впливу на виживання,
- Застосування гідрокортизону в дозі 240-300 мг на добу протягом 5-7 днів прискорює стабілізацію гемодинамічних показників, дозволяє припинити судинну підтримку та покращує виживання у пацієнтів із супутньою відносною наднирковою недостатністю (категорія доказів B).
Необхідно відмовитися від хаотичного емпіричного призначення преднізолону та дексаметазону – немає підстав для екстраполяції на них нової інформації. За відсутності лабораторних доказів відносної надниркової недостатності вводять гідрокортизон у дозі 300 мг на добу (у 3-6 ін'єкцій).
- при рефрактерному шоці,
- якщо для підтримки ефективної гемодинаміки потрібні високі дози вазопресорів.
Можливо, що в умовах системного запалення при септичному шоці ефективність гідрокортизону пов'язана з активацією інгібітора ядерного фактора kB (NF-kB-a) та корекцією відносної надниркової недостатності. У свою чергу, пригнічення активності транскрипційного ядерного фактора (NF-kB) призводить до зменшення утворення індуцибельної NO-синтетази (NO є найпотужнішим ендогенним вазодилататором), прозапальних цитокінів, ЦОГ та молекул адгезії.
Активований протеїн С
Одним із характерних проявів сепсису є порушення системної коагуляції (активація каскаду згортання крові та пригнічення фібринолізу), що зрештою призводить до гіпоперфузії та порушення функції органів. Вплив активованого протеїну С на запальну систему реалізується кількома способами:
- зменшення прикріплення селектинів до лейкоцитів, що захищає ендотелій від пошкодження, що відіграє ключову роль у розвитку системного запалення,
- знижене вивільнення цитокінів з моноцитів,
- блокування вивільнення TNF-α з лейкоцитів,
- пригнічення вироблення тромбіну (це посилює запальну реакцію).
Антикоагулянтна, профібринолітична та протизапальна дія
- активований протеїн С зумовлений
- деградація факторів Va та VIIIa - пригнічення утворення тромбів,
- пригнічення інгібітора активатора плазміногену - активація фібринолізу,
- прямий протизапальний вплив на ендотеліальні клітини та нейтрофіли,
- захист ендотелію від апоптозу
Введення активованого протеїну С [дротрекогін альфа (активований)] у дозі 24 мкг/(кг год) протягом 96 год знижує ризик смерті на 19,4%. Показання до застосування: сепсис з гострим MOF та високим ризиком смерті (APACHE II > 25 балів, дисфункція 2 або більше органів, категорія доказів B).
Активований протеїн С не знижує смертність у дітей, пацієнтів з дисфункцією одного органу, за шкалою APACHE II < 25 балів, у пацієнтів з нехірургічним сепсисом.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Імуноглобуліни
Доцільність внутрішньовенного введення імуноглобулінів (IgG та IgG+IgM) пов'язана з їхньою здатністю обмежувати надмірну дію прозапальних цитокінів, збільшувати кліренс ендотоксинів та стафілококового суперантигену, усувати анергію та посилювати ефект β-лактамних антибіотиків. Їх використання в лікуванні тяжкого сепсису та септичного шоку є єдиним методом імунокорекції, що підвищує виживаність. Найкращий ефект зафіксовано при використанні комбінації IgG та IgM [RR=0,48 (0,35-0,75), категорія доказів А]. Стандартний режим дозування становить 3-5 мл/(кг х добу) протягом 3 днів поспіль. При використанні імуноглобулінів найоптимальніші результати отримані на ранній стадії шоку («теплий шок») та у пацієнтів з тяжким сепсисом (оцінка за шкалою APACHE II 20-25 балів).
Профілактика тромбозу глибоких вен
Профілактика тромбозу глибоких вен нижніх кінцівок суттєво впливає на результати лікування пацієнтів із сепсисом (категорія доказів А). Для цієї мети використовуються як нефракціоновані, так і низькомолекулярні гепарини. Основними перевагами низькомолекулярних гепаринів є нижча частота геморагічних ускладнень, слабший вплив на функцію тромбоцитів та тривалий ефект (можна вводити один раз на день).
Профілактика утворення стресових виразок шлунково-кишкового тракту
Цей напрямок відіграє значну роль у сприятливому результаті лікування пацієнтів з тяжким сепсисом та септичним шоком, оскільки рівень смертності від кровотечі зі стресових виразок шлунково-кишкового тракту становить 64-87%. Без профілактичних заходів стресові виразки виникають у 52,8% критично хворих пацієнтів. Однак застосування інгібіторів протонної помпи та блокаторів гістамінових Н2-рецепторів знижує ризик більш ніж у 2 рази (перша група препаратів ефективніша за другу). Основним напрямком профілактики та лікування є підтримка pH у межах 3,5-6,0. Слід наголосити, що крім вищезазначених препаратів, важливу роль у запобіганні утворенню стресових виразок відіграє ентеральне харчування.
Екстракорпоральне очищення крові
Різні біологічно активні речовини та продукти метаболізму, що беруть участь у розвитку генералізованого запалення, є мішенями для методів детоксикації, що особливо важливо за відсутності природного гепаторенального кліренсу в умовах поліорганної недостатності. Методи замісної ниркової терапії вважаються перспективними, оскільки вони можуть впливати не лише на уремічні порушення у пацієнтів з нирковою недостатністю, але й позитивно впливати на інші зміни гомеостазу та порушення функції органів, що виникають при сепсисі, шоці та поліорганній недостатності.
На сьогоднішній день немає даних, що підтверджують необхідність використання екстракорпоральних методів очищення крові як одного з основних напрямків патогенетичної терапії сепсису та септичного шоку. Їх використання виправдане при поліорганній недостатності з домінуванням нирок.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Гемодіаліз
Суть методу полягає в дифузії речовин низької молекулярної маси (до 5x103 Да ) через напівпроникну мембрану та виведенні надлишку рідини з організму вздовж градієнта тиску. Гемодіаліз широко використовується для лікування пацієнтів як з хронічною, так і з гострою нирковою недостатністю. Швидкість дифузії речовин експоненціально залежить від їх молекулярної маси. Наприклад, видалення олігопептидів відбувається повільніше, ніж їх синтез.
Гемофільтрація
Гемофільтрація є ефективним методом виведення речовин з молекулярною масою 5x103 - 5x104 Да та єдиним способом виведення з організму великої групи біологічно активних речовин та метаболітів. Метод базується на конвекційному методі масопереносу. Окрім адекватної корекції азотемії, гемофільтрація ефективно видаляє анафілатоксини C3a, C5a, прозапальні цитокіни (TNF-a, IL-1b, 6 та 8), ß2-мікроглобулін, міоглобін, паратиреоїдний гормон, лізоцим (молекулярна маса - 6000 Да), α-амілазу (молекулярна маса - 36 000-51 000 Да), креатинфосфокіназу, лужну фосфатазу, трансамінази та інші речовини. Гемофільтрація видаляє амінокислоти та білки плазми (включаючи імуноглобуліни та циркулюючі імунні комплекси).
Гемодіафільтрація
Гемодіафільтрація – найпотужніший метод очищення крові, що поєднує дифузію та конвекцію (тобто ГД та ГФ). Додатковий внесок у процес детоксикації робить сорбція патологічних речовин на мембрані фільтра.
Плазмаферез
Плазмаферез (плазмаферез, плазмофільтрація) також розглядається як можливий метод корекції генералізованого запалення у пацієнтів із сепсисом та септичним шоком. Оптимальним методом вважається використання плазмаферезу в безперервному режимі з видаленням 3-5 об'ємів плазми та одночасною її заміною свіжозамороженими, альбуміновими, колоїдними та кристалоїдними розчинами. При коефіцієнті просіювання 1 плазмофільтрація забезпечує хороше видалення С-реактивного білка, гаптоглобіну, фрагмента комплементу С3, 1-антитрипсину, ІЛ-6, тромбоксану-В2, гранулоцитостимулюючого фактора, ФНП. Використання сорбентів для очищення плазми пацієнта знижує ризик інфекції та зменшує вартість процедури, оскільки немає потреби у використанні чужорідних білків.
Застосування тривалої інфузії селеніту натрію (селенази) 1000 мкг/добу при тяжкому сепсисі призводить до зниження смертності.
Селен – це есенціальний мікроелемент, важливість якого пов’язана з його ключовою роллю в антиоксидантних системах клітин. Рівень селену в крові підтримується в межах 1,9-3,17 мкМ/л. Потреба в селені становить 50-200 мкг на добу, і вона залежить від наявності інших антиоксидантів та мікроелементів.
Селен – потужний антиоксидант, компонент глутатіонпероксидази, фосфолінглутатіонпероксидази, інших оксидоредуктаз та деяких трансфераз. Глутатіонпероксидаза є найважливішою ланкою ендогенної антиоксидантної системи.
Ефективність селену в критичних станах вивчалася в останні роки. Ці дослідження показали, що основними механізмами дії селену є:
- пригнічення гіперактивації NF-kB;
- зниження активації комплементу;
- його дія як імуномодулятора, антиоксиданту та протизапального засобу
- підтримка використання перекису;
- пригнічення ендотеліальної адгезії (зниження експресії ICAM-1, VCAM-2,
- E - селектин, P - селектин);
- захист ендотелію від оксирадикалів (за допомогою селенопротеїну Р, який запобігає утворенню пероксинітриту з O2 та NO).
Підсумовуючи вищесказане, можна визначити конкретні завдання інтенсивної терапії при тяжкому сепсисі:
- Гемодинамічна підтримка: ЦВТ 8-12 мм рт. ст., середній артеріальний тиск >65 мм рт. ст., діурез 0,5 мл/(кг·год), гематокрит >30%, сатурація змішаної венозної крові >70%.
- Піковий тиск у дихальних шляхах для респіраторної підтримки <35 см H2O, інспіраторна фракція кисню <60%, дихальний об'єм <10 мл/кг, співвідношення вдиху та видиху в неінвертованому стані.
- Глюкокортикоїди – «низькі дози» (гідрокортизон 240-300 мг на добу).
- Активований протеїн С 24 мкг/(кг год) протягом 4 днів при тяжкому сепсисі (APACHE II >25).
- Імунокорекціонна замісна терапія пентаглобіном.
- Профілактика тромбозу глибоких вен нижніх кінцівок.
- Профілактика утворення стресових виразок шлунково-кишкового тракту: застосування інгібіторів протонної помпи та блокаторів Н2-гістамінових рецепторів.
- Замісна терапія при гострій нирковій недостатності.
- Харчова підтримка: енергетична цінність їжі 25-30 ккал/кг маси тіла х добу), білок 1,3-2,0 г/(кг маси тіла х добу), глутаміндипептиди 0,3-0,4 г/(кг х добу), глюкоза - 30-70% небілкових калорій за умови підтримки глікемії <6,1 ммоль/л, жири - 15-50% небілкових калорій.

