Медичний експерт статті
Нові публікації
Ліки
Ліки, що запобігають тромбоутворенню та поліпшують реологію крові
Останній перегляд: 07.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
У профілактиці утворення множинних мікротромбів під час шоку та їх руйнування можуть бути використані різні фармакологічні підходи, що використовують препарати, що запобігають утворенню тромбів та покращують реологію крові:
- усунення системних порушень гемодинаміки та мікроциркуляції за допомогою вазоактивних та інотропних засобів;
- заходи щодо покращення реології крові з використанням раціональної інфузійної терапії та препаратів, що відновлюють еластичність мембран еритроцитів (трентал або пентоксифілін);
- запобігання агрегації тромбоцитів та утворенню початкових «білих» тромбів у дрібних артеріальних судинах з подальшою ініціацією каскаду згортання крові;
- пригнічення утворення тромбів після активації системного каскаду згортання крові;
- активація фібринолізу з метою розчинення новоутворених тромбів (фібринолізин, стрептокіназа, стрептодеказа, урокіназа тощо) або, навпаки, пригнічення фібринолізу при його генералізації у деяких пацієнтів з травматичним шоком та сепсисом (амінокапронова кислота, амбен, контрикал тощо).
Більшість перелічених підходів є традиційними, добре розробленими в практиці лікування шоку, мають власні гемореологічні показання та зазначені у відповідних розділах. Тому в цьому розділі доцільно зупинитися на розгляді загального підходу до профілактики тромбоутворення при шоці з використанням фармакологічних засобів, що впливають на профазу згортання крові. Саме цей рівень профілактики коагуляційних ускладнень – виникнення, формування та зростання «білих артеріальних тромбів» – привертає найбільшу увагу дослідників.
Для різних видів шоку характерні різноманітні та часто різноспрямовані порушення згортання крові з погіршенням її реології. Найбільш характерним для септичного, ендотоксинового, опікового, травматичного та геморагічного видів шоку є утворення множинних мікротромбів у найдрібніших судинах, що спричинене порушеннями системної гемодинаміки, вазоспазмом та порушеннями мікроциркуляції, згущенням крові, її сладжуванням, зниженням еластичності мембран еритроцитів, а також численними загальними та місцевими факторами (аутокоїдами), що ініціюють локальні зміни коагуляційного гемостазу та включення профази згортання крові.
У схематичному (скороченому) вигляді початкова стадія гемокоагуляції та механізм локального гомеостазу гемокоагуляції представлені наступним чином.
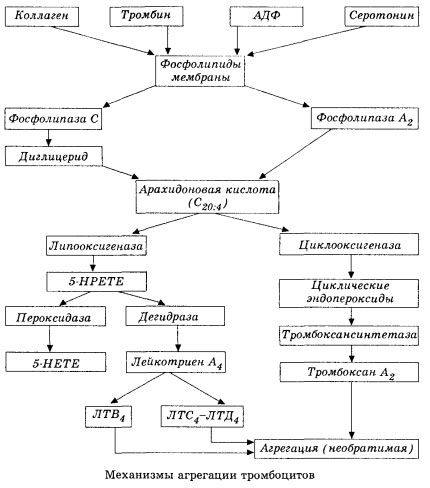
Він починається з активації мембранної фосфоліпази А2 в результаті впливу комбінації пошкоджувальних факторів (пряме пошкодження мембрани, гіпоксія, перекисне окислення ліпідів, вплив ендогенних хімічних факторів тощо). В результаті розпаду мембранних фосфоліпідів вивільняються неестерифіковані довголанцюгові жирні кислоти, з яких найважливішим вихідним субстратом є арахідонова кислота. Її трансформація (каскад арахідонової кислоти) відбувається через ліпоксигеназний (синтез лейкотрієнів) та циклооксигеназний (синтез простагландинів, тромбоксанів, простацикліну) шляхи.
Утворені лейкотрієни (B4, C4, E4, D4 та ін.) – речовини з надзвичайно високою біологічною активністю, до яких належить і повільно реагуюча речовина анафілаксії – мають велике значення в ініціації місцевих судинних, запальних та імунних реакцій, включаючи аутоімунні процеси. Лейкотрієни викликають порушення мікроциркуляції, підвищення згортання крові, вивільнення аутолітичних лізосомальних ферментів та виділення в кров фактора, що пригнічує скоротливість міокарда та спазм бронхів.
Завдяки своїй здатності викликати скорочення гладкої мускулатури, лейкотрієни суттєво впливають на системну гемодинаміку, коронарні судини та міокард, надаючи потужний коронарний констрикторний та негативний інотропний ефект, що супроводжується зниженням серцевого викиду та відіграє важливу роль у розвитку гіпотензії.
Зниження серцевого викиду та гіпотензивна реакція на лейкотрієни пов'язані з ослабленням серцевого м'яза та обмеженням венозного повернення до серця. Істотне значення в обмеженні венозного повернення має здатність лейкотрієнів збільшувати проникність судинної стінки та викликати екстравазацію плазми. Лейкотрієни вважаються важливими в патогенезі інфаркту міокарда.
При анафілактичному та септичному (ендотоксиновому) шоці їхня роль, очевидно, ще більше зростає, про що свідчить здатність лейкотрієнів накопичуватися в значних кількостях у плазмі під час алергічних реакцій та викликати зміни системного кровотоку, характерні для анафілактичного шоку, а також захисні ефекти блокаторів лейкотрієнових рецепторів та інгібіторів ліпоксигенази. Розробка селективних блокаторів лейкотрієнових рецепторів ведеться досить інтенсивно та є перспективним напрямком науки. У цій галузі вже досягнуто певних успіхів, а ефективність таких блокаторів при ішемії міокарда, ендотоксиновому та геморагічному шоці підтверджена експериментально. Однак, ймовірно, знадобиться ще кілька років, перш ніж цей напрямок буде впроваджено в клінічній практиці.
Якщо у венозних судинах тромби утворюються за рівної участі тромбоцитів та плазмових факторів згортання крові, то в артеріях основними ініціаторами процесу є тромбоцити. Вони містять АДФ, Са2+, серотонін, фосфоліпіди, ферменти синтезу простагландинів та тромбоксану, тромбостенін (подібно до м'язового актоміозину, забезпечує скоротливу здатність цих клітин), тромбогенний фактор росту епітелію та м'язових клітин судинної стінки та ряд інших речовин. Гуморальна регуляція функцій тромбоцитів здійснюється через спеціалізовані рецептори їх мембран (альфа2- та бета2-адренорецептори, рецептори гістаміну та серотоніну, ацетилхоліну, тромбоксану, аденозину та ряд інших). Особливою властивістю тромбоцитів є висока спорідненість до колагену та інших субендотеліальних елементів судинної стінки, до незмочуваних та негативно заряджених поверхонь. Ця властивість забезпечує тромбоцитам виняткову здатність адгезувати (прилипати) до ділянки судини з пошкодженим ендотелієм, який має широкі можливості пошкодитися під час шоку. У цьому випадку тромбоцити розходяться та вивільняють псевдоподії, які можуть прилипати одна до одної та до стінки судини. Проникність мембрани збільшується, і з тромбоцитів вивільняються АДФ, серотонін, тромбоксан та деякі фактори згортання крові, адсорбовані на поверхні тромбоцита. Ці речовини взаємодіють з відповідними рецепторами на мембрані та за участю іонів кальцію викликають агрегацію (спочатку оборотну). Процес стає самопідтримуваним, чому сприяють гуморальні регуляторні фактори; інші фактори, навпаки, можуть зупинити його та навіть звернути у зворотний бік, викликаючи дезагрегацію.
При переважанні тромбоутворюючих впливів та умов фази адгезії та оборотної агрегації змінюються третьою фазою - необоротною агрегацією, яка здійснюється за участю тромбостеніну та призводить до звуження згустку; реакція посилення агреганта та звуження також відбувається за участю Ca+, АТФ та призводить до утворення білого тромбу.
Циклооксигеназний шлях перетворення арахідонової кислоти в тромбоцитах, судинних ендотеліальних клітинах та інших тканинах забезпечує локальний (період напіввиведення метаболітів дуже короткий) гомеостаз коагуляції, оскільки під час цього метаболізму утворюються потужні про- та антиагрегантні речовини. Основним фактором, що активує агрегацію тромбоцитів у циклооксигеназному ланцюзі реакцій, є тромбоксан А2, а його не менш потужним антагоністом – простациклін, що виробляється ендотеліальними клітинами та, меншою мірою, простагландинами серії E та G. Нарешті, на агрегацію тромбоцитів сильно впливають додаткові локальні та системні гуморальні фактори.
Активатори та інгібітори агрегації тромбоцитів
Ініціатори та активатори агрегації тромбоцитів |
Інгібітори агрегації тромбоцитів |
Колаген |
- |
АДФ |
Аденозин та його стабілізатори |
Норадреналін (через альфа2-рецептори) |
Альфа-адреноблокатори |
Серотонін |
Антисеротонінові засоби |
Гістамін |
Антигістамінні препарати |
Тромбін |
Гепарин |
Са2+ |
Антагоністи Ca2+ |
ЦГМФ - його індуктори (ацетилхолін?) та стабілізатори |
КАМ - її індуктори (через бета-адренергічні рецептори) та стабілізатори (інгібітори фосфодіестерази) |
Арахідонова кислота |
Декстрани, альбумін |
Тромбоксан А2 |
Простациклін I2 |
Фармакологічні втручання на початковій фазі тромбоутворення при шоці та гострих ішемічних процесах у серці та мозку свідчать про таку можливість:
- пригнічення початкових реакцій (повного та часткового) каскаду арахідонової кислоти;
- пригнічення певної реакції синтезу тромбоксану;
- блокування рецепторів до лейкотрієнів і тромбоксанів у тромбоцитах, гладких м'язах та інших клітинах;
- використання речовин, що модулюють агрегацію тромбоцитів, тобто послаблюють іншими способами реакцію останніх на вплив ініціюючих факторів (колаген, тромбоксан А2, лейкотрієни тощо).
Реалізація перелічених способів корекції порушень реологічних властивостей крові передбачає вирішення основного тактичного завдання: захистити рецептори агрегації та адгезії тромбоцитів від впливу активаторів або придушити внутрішньоклітинні механізми синтезу цих рецепторів. Гальмування початкових реакцій каскаду арахідонової кислоти може бути досягнуто шляхом захисту рецепторів тромбоцитів, що реагують на полімерні активатори, за допомогою низькомолекулярних декстранів, молекули яких конкурують з фібрином, колагеном, агрегованим імуноглобуліном (IgE) та компонентами системи комплементу.
Маскуючи рецептори на мембрані тромбоцитів та конкуруючи з великодисперсними білками на поверхні еритроцитів, низькомолекулярні декстрани витісняють їх та руйнують містки між клітинами. Це пов'язано з тим, що декстрани, обволікаючи судинний ендотелій та поверхню клітинних елементів крові, збільшують їхній негативний заряд, тим самим посилюючи антиагрегаційні властивості.
Декстранс
Низькомолекулярні декстрани зменшують агрегацію тромбоцитів, індуковану колагеном та АДФ, а також активуючий вплив тромбіну на тромбоцити, пригнічують ріст початкового білого тромбоцитарного тромбу, покращують кровотік, зменшують післяопераційне збільшення вмісту фібриногену в плазмі, змінюють структуру та стабільність фібрину.
Внутрішньовенні інфузії декстранів при травмах та шоці не тільки зменшують агрегацію та адгезію тромбоцитів, але й мобілізують ендогенний гепарин, тим самим сприяючи утворенню пухкого та погано втягуваного кров'яного згустку, який легко лізується фібринолітиками. Антитромбінова активність низькомолекулярних декстранів пов'язана з їх специфічним впливом на структуру та функцію фактора згортання крові VIII. Фактор VIII (антигемофільний глобулін), велика молекула зі складною структурою та функцією, бере участь в агрегації тромбоцитів та стабільності утвореного згустку. Декстрани перешкоджають дії фактора VIII, тим самим уповільнюючи агрегацію тромбоцитів та знижуючи стабільність згустку.
Низькомолекулярні декстрани не є справжніми антикоагулянтами, і їх коригувальний ефект при гемореологічних порушеннях пов'язаний головним чином з гемодилюцією, поповненням об'єму циркулюючої плазми та покращенням кровотоку в системі мікроциркуляції.
Здатність декстранів покращувати кровотік при гемодинамічних порушеннях (шок, крововтрата) зумовлена комплексом факторів. Виникнення високої транзиторної концентрації полімеру в крові не тільки призводить до «прямої гемодилюції», але й створює умови для надходження рідини в кровотік з інтерстиціального простору та подальшого збалансування осмотичного ефекту декстрану. Як наслідок гемодилюції, в'язкість крові зменшується, венозний приплив до серця збільшується, а серцевий викид збільшується. Поряд з цими ефектами, декстран утворюють комплекси з фібриногеном та мають антиліпемічну дію.
Таким чином, антиагрегаційна дія та гемодинамічні ефекти низькомолекулярних декстранів сприяють зниженню в'язкості крові, що особливо важливо при низьких швидкостях зсуву. Дезагрегація клітин крові покращує системний кровотік та мікроциркуляцію, особливо у венозній його частині, де градієнти швидкості найнижчі. Застосування розчинів низькомолекулярних декстранів при різних видах шоку, під час хірургічного лікування травм та їх наслідків, а потім у післяопераційному періоді допомагає запобігти гіперкоагуляції та зменшити ймовірність тромботичних процесів та емболії.
Однак слід зазначити, що в деяких випадках інфузії розчинів декстрану супроводжуються анафілактичними та алергічними реакціями (небезпечно за наявності сенсибілізації та анафілактичного шоку). Це пов'язано з тим, що декстрани, які мають велику молекулярну масу та багато бічних ланцюгів, можуть виступати в ролі антигену. Тому для встановлення індивідуальної чутливості рекомендується попередньо ввести внутрішньовенно до 20 мл низькомолекулярного розчину декстрану як гаптен (15% розчин, молекулярна маса 1000) та провести інфузії плазмозамінника перед введенням анестезії.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Інгібітори тромбіну
Фармакологічний захист рецепторів тромбоцитів, що взаємодіють з активаторами тромбоцитів, також може бути досягнутий за допомогою агентів, які конкурують з неполімерними активаторами тромбоцитів або пригнічують їх. До таких агентів належать інгібітори тромбіну (гепарин та гірудин, ряд синтетичних інгібіторів, антагоністи адреналіну), блокатори альфа-рецепторів (фентоламін, дигідроерготамін), антагоністи АДФ (дипіридамол, аденозин та його структурні аналоги, фосфокреатин), антагоністи серотоніну (метисергід). Лише деякі з перелічених агентів фактично використовуються для профілактики та терапії шоку різного походження.
Захист внутрішньоклітинних механізмів синтезу білкових рецепторів, що реагують з активаторами агрегації та адгезії тромбоцитів, та пригнічення процесів синтезу тромбоксану можливі за допомогою препаратів різних груп:
- індуктори та стабілізатори цАТФ, простацикліну та простагландину PgE2;
- інгібітори фосфоліпази та фосфодіестерази.
Інтенсивна розробка спеціальних антиагрегантів розпочалася відносно недавно і поки що не призвела до достовірних результатів. Наразі в клінічній практиці, крім розчинів декстрану, для запобігання утворенню білих тромбоцитних тромбів широко використовуються такі антиагреганти, як ацетилсаліцилова кислота, індометацин, дипірадамол, сульфінпіразон (персантин), простациклін (ейкопростенон) та гепарин.
Нестероїдні протизапальні препарати
Встановлено, що фармакологічні ефекти нестероїдних протизапальних препаратів – ацетилсаліцилової кислоти та індометацину – зумовлені їх впливом на метаболізм ейкозаноїдів (тромбоксанів та простагландинів). Майже всі препарати цієї групи пригнічують ферментний комплекс, відомий як простагландинсинтетаза, тим самим здійснюючи свою специфічну та антиагрегантну дію.
Ацетилсаліцилова кислота дуже швидко всмоктується після перорального застосування. Продукт її гідролізу, саліцилова кислота, викликає пригнічення циклооксигенази тромбоцитів, що порушує перетворення арахідонової кислоти на простагландин О2 і, зрештою, тромбоксан А2. Ацетилсаліцилова кислота пригнічує агрегацію, індуковану колагеном, АДФ, адреналіном та серотоніном. Хоча її GG05 становить 15 хвилин, антиагрегантний ефект триває кілька днів, що, очевидно, пояснюється незворотним пригніченням реакцій синтезу простагландинів та пригніченням агрегаційної функції тромбоцитів протягом усього їхнього життя (6-10 днів). Поряд з пригніченням циклооксигенази тромбоцитів, ацетилсаліцилова кислота у високих дозах пригнічує циклооксигеназу судинної стінки та одночасно з пригніченням синтезу тромбоксану А2 пригнічує синтез простацикліну в ендотеліальних клітинах. Тому ацетилсаліцилову кислоту слід призначати як антиагрегант у малих дозах (3000-5000 мг/добу), які переважно пригнічують агрегацію тромбоцитів.
Враховуючи, що ацетилсаліцилова кислота блокує циклооксигеназу тромбоцитів протягом кількох днів, а ендотеліальну циклооксигеназу – не більше доби, раціонально призначати препарат не щодня, а кожні 3-4 дні. Підбір оптимальної дози ацетилсаліцилової кислоти для пацієнта слід проводити індивідуально, оскільки існує різна чутливість пацієнтів до антиагрегантної дії препарату. У реактивних пацієнтів ацетилсаліцилова кислота в дозі 0,5 г пригнічує агрегацію тромбоцитів на 40-50%, у гіперреактивних пацієнтів – повністю або на 80-90%, а для ареактивних пацієнтів характерна відсутність антиагрегантної дії при прийомі тієї ж дози препарату.
Селективними інгібіторами тромбоксансинтетази є імідазол та його аналоги, які не блокують циклооксигеназу. Дипіридамол, що використовується в клінічній практиці при лікуванні хронічної ішемічної хвороби серця як коронаророзширювач, подібно до імідазолу, селективно пригнічує тромбоксансинтетазу, запобігаючи синтезу тромбоксану А2. Вважається, що препарат та його аналоги також пригнічують фосфодіестеразу тромбоцитів, тим самим підвищуючи концентрацію цАМФ у тромбоцитах. Поряд з цим, дипіридамол пригнічує активність аденозиндезамінази та поглинання аденозину тромбоцитами, блокує поглинання серотоніну тромбоцитами та їх агрегацію, індуковану адреналіном та колагеном. Є повідомлення про слабку антитромбоцитарну активність препарату та його здатність у малих дозах посилювати агрегацію тромбоцитів. Найбільш надійний антитромбоцитарний ефект може бути досягнутий при комбінації дипіридамолу та ацетилсаліцилової кислоти.
Гепарин
Серед антитромботичних засобів одним із найефективніших регуляторів агрегатного стану крові є гепарин, особливо при ранньому застосуванні. Гепарин має високий негативний заряд і здатний взаємодіяти як з великими, так і з малими іонами та молекулами (ферментами, гормонами, біогенними амінами, білками плазми тощо), тому спектр його біологічної дії досить широкий. Препарат має антитромбінову, антитромбопластинову та антипротромбінову дію, запобігає перетворенню фібриногену на фібрин, пригнічує ретракцію тромбу та посилює фібриноліз.
Механізм антикоагулянтної дії гепарину є досить складним. Наразі встановлено, що антикоагулянтні ефекти гепарину пов'язані з посиленням дії антитромбіну III та посиленням здатності комплексу гепарин-антитромбін III швидко інактивувати більшість серинових протеаз системи згортання крові. В антитромботичній дії гепарину велике значення має його здатність підвищувати та підтримувати високий електронегативний потенціал інтими судин, запобігаючи адгезії тромбоцитів та утворенню тромбоцитарних мікротромбів. Гепарин найактивніше пригнічує утворення тромбоцитів у венах, запобігаючи як локальному тромбоутворенню, так і дисемінованому внутрішньосудинному згортанню крові.
Простациклін та його стабільні аналоги
Серед антиагрегантів найпотужнішими інгібіторами агрегації є простациклін та його стабільні аналоги. Антиагрегантна дія простацикліну зумовлена стимуляцією аденілатциклази та, як наслідок, підвищенням концентрації цАМФ у тромбоцитах, зниженням вмісту тромбоксану, зменшенням вмісту тромбоксану А2 та блокадою його рецепторів. Простациклін нестабільний і швидко гідролізується до неактивних продуктів, тому його вводять внутрішньовенно крапельно зі швидкістю від 2 до 20 нг/кг за хвилину протягом 30-60 хвилин до 6 разів на день.
Простациклін, поряд із сильним антиагрегаційним ефектом, має потужний вазодилататорний та бронходилататорний ефект. Препарат розширює судини мозку, серця, нирок, скелетних м'язів та брижових судин. Під впливом простацикліну збільшується коронарний кровотік, збільшується енергопостачання міокарда та зменшується його потреба в кисні. Незважаючи на його нестабільність в організмі, клінічно сприятливі ефекти можуть тривати протягом кількох тижнів і навіть місяців. Механізм такої тривалої дії поки що не з'ясований.
Простациклін є малотоксичним препаратом, але його застосування може викликати побічні ефекти: почервоніння обличчя, головний біль, зниження артеріального тиску, біль у животі, анорексію. Поряд з простацикліном, його синтетичні стабільні аналоги (ілопрост та ін.) є перспективними інгібіторами агрегації тромбоцитів.
Ліки, що покращують в'язкість крові
Порушення реологічних властивостей крові під час травми та шоку зумовлені не лише змінами функціональної активності тромбоцитів, але й підвищенням в'язкості крові. Структурна в'язкість крові як складної динамічної дисперсної системи значною мірою визначається в'язкістю плазми та здатністю еритроцитів до деформації. В'язкість плазми залежить головним чином від концентрації білків у крові. Білки з малою молекулярною масою, такі як альбумін, мало впливають на в'язкість плазми, тоді як білки з великою молекулою (фібриноген, альфа- та гамма-глобуліни, інші макромолекули) значно її підвищують.
При низьких швидкостях зсуву адсорбція фібриногену та глобулінів на поверхні еритроцитів призводить до утворення містків між сусідніми клітинами та формування агрегатів з еритроцитів. Швидкість утворення агрегатів є складним біофізичним процесом і залежить не тільки від величини зсуву, але й від електрокінетичних властивостей еритроцитів, концентрації, маси та сорбційної здатності макромолекул-агрегаторів, від форми та пластичності еритроцитів.
Підтримка форми та механічних властивостей мембрани еритроцитів вимагає значних енергетичних витрат. Вважається, що енергія, що виробляється в еритроцитах під час гліколізу, витрачається на фосфорилювання спектрину, що призводить до змін вторинної структури білка та взаємодії з сусідніми компонентами внутрішньої мембрани. Взаємодія між структурними білками мембрани, спектрином та актином, відіграє важливу роль у формуванні механічних властивостей мембрани еритроцитів, у підтримці постійної площі поверхні еритроцита та його товщини за будь-якої деформації.
При системних гемодинамічних та органних порушеннях кровотоку підвищення жорсткості еритроцитарних мембран та утворення еритроцитарних агрегатів призводить до зниження швидкості проходження еритроцитів через капіляри, тим самим порушуючи газотранспортну функцію крові. Тому корекція порушень реологічних властивостей крові при шоці повинна включати, поряд із запобіганням агрегації еритроцитів, нормалізацію в'язкості плазми та крові, агрегацію та деформацію еритроцитів.
Окрім низькомолекулярних декстранів, розчини альбуміну є одним із ефективних засобів підвищення суспензійної стабільності крові. У пізньому періоді шоку відбувається генералізована агрегація еритроцитів на тлі зниження концентрації альбуміну в плазмі крові та підвищення концентрації фібриногену та глобулінів, особливо альфа2-фракції, ліпопротеїнів та ліпідів. За цих умов реологічні ефекти альбуміну зумовлені двома основними факторами: гемодилюцією та нормалізацією співвідношення між мікро- та макроглобулярними білками в плазмі. Водночас альбумін зв'язує вільні кислоти, лабілізація яких під час травми та шоку стимулює агрегацію клітинних структур крові та внутрішньосудинне згортання крові та може спричинити жирову емболію.
Протишокові заходи, спрямовані на поповнення об'єму циркулюючої крові, усунення тканинної гіпоксії та метаболічного ацидозу, сприяють нормалізації еластичності мембран еритроцитів, оскільки гіпоксія та ацидоз значно знижують деформованість еритроцитів. Підвищена жорсткість мембран еритроцитів при шоці, ймовірно, пов'язана з пригніченням синтезу АТФ в еритроцитах. У свою чергу, зниження концентрації АТФ сприяє збільшенню концентрації Ca2+ в еритроцитах, який, зв'язуючись з мембранними білками, підвищує жорсткість мембрани.
Одним із фармакологічних препаратів, що підвищує вміст АТФ в еритроцитах та еластичність мембран еритроцитів, є Трентал (пентоксифілін), який використовується в клінічній практиці для лікування ішемічних розладів.
Поряд зі зниженням жорсткості мембран еритроцитів, Трентал викликає вазодилатацію, покращує оксигенацію тканин, пригнічує активність фосфодіестерази в тканинах, підвищує концентрацію цАМФ та пригнічує агрегацію тромбоцитів.
Серед інших фармакологічних засобів, що підтримують еластичність мембрани еритроцитів, варто відзначити антагоністи Ca2+, які обмежують надходження іонів в еритроцити (флунаризин, ніфедипін тощо).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Увага!
Для простоти сприйняття інформації, дана інструкція із застосування препарату "Ліки, що запобігають тромбоутворенню та поліпшують реологію крові" переведена і викладена в особливій формі на підставі офіційної інструкції для медичного застосування препарату. Перед застосуванням ознайомтеся з анотацією, що додається безпосередньо до медичного препарату.
Опис надано з ознайомчою метою і не є керівництвом до самолікування. Необхідність застосування даного препарату, призначення схеми лікування, способів і дози застосування препарату визначається виключно Лікуючим лікарем. Самолікування небезпечно для Вашого здоров'я.

