Сказ у дітей
Останній перегляд: 24.06.2018

Ми маємо суворі правила щодо джерел інформації та посилаємося лише на авторитетні медичні сайти, академічні дослідницькі установи та, по можливості, на медично рецензовані дослідження. Зверніть увагу, що числа в дужках ([1], [2] тощо) є клікабельними посиланнями на ці дослідження.
Якщо ви вважаєте, що будь-який з наших матеріалів є неточним, застарілим або іншим чином сумнівним, будь ласка, виберіть його та натисніть Ctrl + Enter.
Сказ, або гідрофобія, – це гостре вірусне захворювання, що передається через укус зараженої тварини, з ураженням нервової системи та розвитком важкого енцефаліту з летальним результатом.
Вірус сказу, що є лихом для громадського здоров'я з давніх часів, наразі спричиняє приблизно 59 000 смертей людей щороку, майже всі з яких передаються через укуси собак. Це має значний економічний вплив на країни, що розвиваються, особливо в Африці та Азії, які можуть понести найменші такі втрати. Однак, незважаючи на майже 100% рівень смертності, сказ собак є повністю запобіжним захворюванням, і історичні приклади ліквідації сказу собак у розвинених країнах це підтверджують. [ 1 ]
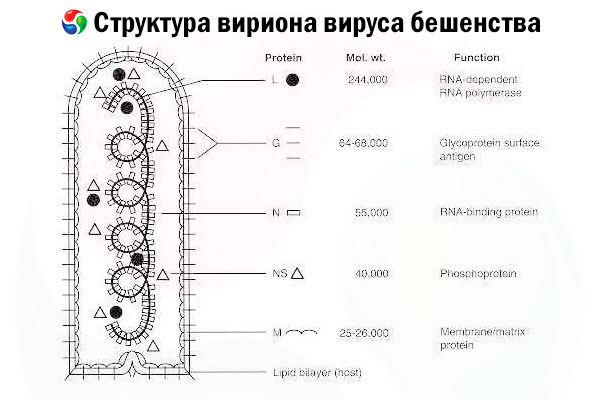
Збудником є вірус сказу (ВСК), негативно-ланцюговий РНК-вірус родини рабдовірусів, розміром приблизно 60 нм × 180 нм.
Він складається з внутрішнього білкового ядра, або нуклеокапсиду, що містить нуклеїнову кислоту, та зовнішньої мембрани — ліпідного бішару, покритого трансмембранними глікопротеїновими шипами. Він має відносно просту модульну структуру геному та кодує п'ять структурних білків:
- РНК-залежна РНК-полімераза (L),
- нуклеопротеїн (N),
- фосфорильований білок (P),
- матриксний білок (М) та
- глікопротеїн зовнішньої поверхні (G).
Білки N, P та L разом з геномною РНК утворюють рибонуклеопротеїновий комплекс. G – єдиний антиген ротавірусу, здатний індукувати вироблення нейтралізуючих антитіл до ротавірусу, які є основними імунними ефекторами проти летальної ротавірусної інфекції. З іншого боку, було показано, що рибонуклеопротеїновий комплекс є основним антигеном ротавірусу, здатним індукувати CD4+ Т-клітини, що може посилювати вироблення нейтралізуючих антитіл до ротавірусу шляхом внутрішньоструктурного розпізнавання антигену.[ 2 ] Рибонуклеопротеїновий комплекс може відігравати важливу роль у формуванні імунологічної пам'яті та довготривалого імунітету.[ 3 ]
Класифікація та типи антигенів
Рід Lyssavirus включає вірус сказу та антигенно й генетично споріднені віруси сказу: віруси кажанів Лагоса, Мокола та Дювенхага, а також два ймовірні підтипи європейських ліссавірусів кажанів. Дослідження перехресного захисту показують, що тварини, імунізовані традиційними вакцинами проти сказу, можуть бути не повністю захищені при зараженні іншими ліссавірусами.
Віруси сказу можна класифікувати як фіксовані (адаптовані шляхом пасажу в тваринах або клітинній культурі) або вуличні (дикий тип). Використання моноклональних антитіл та генетичного секвенування для диференціації вуличних вірусів сказу допомогло у виявленні вірусних варіантів, що походять з основних резервуарів хазяїв у всьому світі, та у визначенні ймовірних джерел зараження людини, коли в анамнезі остаточного укусу тварини у випадку пацієнта інакше не було.[ 8 ]
Основним резервуаром і джерелом інфекції серед диких тварин є вовки, лисиці, шакали, кажани, а серед свійських тварин - собаки та коти, рідко - коні, велика рогата худоба, свині, щури тощо. Передача інфекції від людини до людини, хоча й можлива, трапляється вкрай рідко. Це типова зоонозна інфекція. Люди заражаються сказом переважно від собак.
Після укусу людини хворою твариною вірус розмножується в м'язовій тканині в місці укусу, а потім, досягнувши закінчень чутливих периферичних нервів, поширюється доцентрово, досягаючи рухових нейронів. Час, необхідний для переміщення вірусу та ураження мозку, залежить від місця укусу. При сильних укусах голови та обличчя вірус може досягти центральної нервової системи за 15-20 днів, а при незначному пошкодженні шкіри тулуба та кінцівок і, як наслідок, невеликій дозі збудника процес переміщення вірусу до центральної нервової системи може затриматися на кілька місяців або навіть до 1-1,5 років. Досягнувши центральної нервової системи, вірус фіксується в тканинах головного та спинного мозку, переважно в нейронах довгастого мозку, рогу Аммона та основи мозку. У спинному мозку найбільше уражаються задні роги. З центральної нервової системи вірус відцентрово по нервових стовбурах досягає слинних залоз, де розмножується та виділяється зі слиною.
Концепції патогенезу сказу
Рідковірус (РВ) має широкий спектр хазяїв і може інфікувати майже всіх ссавців. Хоча повідомлялося про кілька шляхів передачі РВ, природне зараження найчастіше відбувається через укус. Окрім укусів, вживання туш, інфікованих РВ, може сприяти зараженню песців вірусом сказу, а контакт РВ зі слизовими оболонками був виявлений як ще один можливий шлях передачі.[ 9 ] За деяких незвичайних обставин, таких як випадкове вивільнення РВ у вигляді аерозолю в лабораторії або РВ у вигляді аерозолю в печерах, де мешкає велика кількість кажанів,[ 10 ] може відбуватися передача аерозолю.
Поки що незрозуміло, чи реплікуються вуличні штами ротавірусу, адаптовані до мишей або адаптовані до культури тканин штами ротавірусу в місці інокуляції до потрапляння в ЦНС. Хоча експериментальне внутрішньом'язове зараження молодих хом'яків або єнотів вуличним ротавірусом виявило реплікацію ротавірусу в клітинах поперечно-смугастих м'язів до того, як вірус вторгся в аксони рухових нейронів через нервово-м'язові з'єднання,[ 11 ],[ 12 ] внутрішньом'язове зараження мишей адаптованим до мишей CVS-24 ротавірусом показало, що ротавірус мігрує безпосередньо до ЦНС без попередньої реплікації в місці інокуляції.[ 13 ] Потрапивши в терміналі немієлінізованих аксонів, ротавірус ретроградно транспортується до тіла клітини.
Нещодавні дослідження свідчать про те, що транспортування аксональних везикул може бути ключовою стратегією для переміщення віріонів на великі відстані по аксонах.[ 14 ] За оцінками, вірус респіраторного інфекційного захворювання (РВ) мігрує всередині аксонів зі швидкістю 3 мм/год.[ 15 ] Потім інфекція поширюється через ланцюг нейронів, з'єднаних синаптичними з'єднаннями. Однак точний механізм, що сприяє транссинаптичному поширенню, досі невідомий. Після інфікування мозку вірус поширюється відцентрово до периферичної та вегетативної нервової системи в багатьох периферичних органах.[ 16 ] На останній стадії циклу інфекції РВ мігрує до слинних залоз; після реплікації в мукогенних ацинарних клітинах він вивільняється в слину і готовий до передачі наступному хазяїну.[ 17 ]
Щодо патології, індукованої вірусом сказу, апоптотична загибель клітин була запропонована як потенційний патогенний механізм в експериментальних моделях сказу у мишей, інфікованих фіксованим штамом RV.[ 18 ] Патогенним механізмом, який може сприяти глибокій дисфункції ЦНС, характерній для сказу, може бути порушення нейрональної функції. Було показано, що експресія генів значно знижена в нейронах, інфікованих RV, що призводить до загального пригнічення синтезу білка,[ 19 ] і кілька досліджень показали порушення нейротрансмісії після RV-інфекції. Цзян продемонстрував, що зв'язування антагоніста ацетилхолінових рецепторів з гомогенатами мозку інфікованих щурів було знижено порівняно з контрольною групою.[ 20 ] Порушення вивільнення та зв'язування серотоніну, нейромедіатора, що бере участь у контролі циклу сну, сприйняття болю та поведінки, також спостерігалося в мозку щурів, інфікованих RV.[ 21 ], [ 22 ] Окрім впливу на нейротрансмісію, інфекція правого шлуночка також може впливати на іонні канали. Інфіковані клітини нейробластоми миші демонструють знижену функціональну експресію потенціалзалежних натрієвих каналів, що може запобігати потенціалам дії та зрештою призвести до функціональних порушень. [ 23 ]
Окрім відсутності серйозних патологічних уражень у ЦНС, більшість випадків сказу у людей не викликають імунної відповіді через 7–10 днів після появи клінічних ознак. Ці суттєві відмінності між патогенезом сказу та патогенезом більшості інших вірусних або бактеріальних інфекцій ЦНС додатково підтверджуються тим фактом, що імуносупресія або неефективна, або шкідлива для результату сказу.[ 24 ] Низький рівень імунної відповіді, який часто спостерігається у жертв сказу, викликає подив, оскільки його не можна пояснити низькою імуногенністю антигенів ротавірусу. Фактично, G ротавірусу та нуклеокапсидний білок є потужними B- та T-клітинними антигенами при парентеральному введенні.[ 25 ] Можливим поясненням низького ступеня імунної відповіді проти ротавірусу у людей або тварин, хворих на сказ, може бути те, що ротавірусна інфекція ЦНС викликає імуносупресію,[ 26 ] і було запропоновано, що ротавірус використовує підривну стратегію, включаючи запобігання апоптозу та знищення Т-клітин, що вторгаються.[ 27 ]
Атенуйовані штами ротавірусу, адаптовані до ненейрональних клітин, суттєво відрізняються від патогенних вуличних штамів ротавірусу своєю нейроінвазивністю, яка стосується їхньої здатності проникати в ЦНС з периферичних ділянок. У зв'язку з цим адаптовані до культури тканин штами ротавірусу або не мають, або мають лише обмежену здатність проникати в ЦНС з периферичних ділянок, тоді як вуличні штами ротавірусу або адаптовані до мишей штами ротавірусу, такі як CVS-24, є високоінвазивними.[ 28 ] Ключовими факторами, що беруть участь у нейроінвазії ротавірусу, є поглинання вірусу, аксональний транспорт, транссинаптичне поширення та швидкість реплікації вірусу.
Донедавна наші знання про патогенез ротавірусу були обмеженими та базувалися переважно на описових дослідженнях вуличних штамів ротавірусу або експериментальних інфекцій ослабленими штамами, адаптованими в лабораторії. Поява технології зворотної генетики дозволила нам ідентифікувати вірусні елементи, що визначають патогенний фенотип ротавірусу, та краще зрозуміти механізми, що беруть участь у патогенезі сказу.
Ідентифікація вірусних елементів, що контролюють придбання, поширення та реплікацію вірусу сказу
- Вірусні елементи, що беруть участь у захопленні вірусу
Інфекція RV починається з приєднання вірусу до передбачуваного клітинного рецептора. Хоча кілька молекул поверхні мембрани були запропоновані як рецептори RV, включаючи нікотиновий ацетилхоліновий рецептор,[ 29 ] молекулу адгезії нейронних клітин[ 30 ] та низькоафінний нейротрофіновий рецептор p75 NTR,[ 31 ] досі незрозуміло, чи ці молекули насправді відіграють певну роль у життєвому циклі вірусу сказу. У цьому контексті нещодавно було показано, що взаємодія RV G–p75 NTR не є необхідною для інфікування RV первинних нейронів.[ 32 ] Після зв'язування з рецептором RV інтерналізується через адсорбційний або рецептор-опосередкований ендоцитоз.[ 33 ] Низький pH середовища в ендосомальному компартменті потім індукує конформаційні зміни в RV G, які запускають злиття вірусної мембрани з ендосомальною мембраною, тим самим вивільняючи RNP у цитоплазму.[ 34 ] Для вірусів RV G відіграє вирішальну роль у поглинанні вірусу, найімовірніше, через взаємодію з передбачуваними клітинними рецепторами, що сприяють швидкому поглинанню. У зв'язку з цим було продемонстровано, що патогенність адаптованих до культури тканин штамів ротавірусу (наприклад, ERA, HEP та CVS-11) корелює з наявністю детермінанти, розташованої в антигенному сайті III G-білка. [ 35 ] Мутація Arg → Gln у положенні 333 у цьому антигенному сайті G-білка ERA призвела до семикратної затримки інтерналізації варіанта Gln333 ротавірусу порівняно з варіантом дикого типу. Мутація Asn194→Lys194 в RV G, яка пояснює повторну появу патогенного фенотипу, була пов'язана зі значним зменшенням часу інтерналізації.[ 36 ] Крім того, експерименти з химерними RV показали, що час, необхідний для інтерналізації віріонів RV, значно збільшився, а патогенність значно знизилася після заміни гена G високопатогенного штаму SB RV, який був отриманий з кДНК-клону штаму RV-18, асоційованого з кажанами, отриманого зі срібла,[ 37 ], на ген високоаттенуйованого штаму SN, який був виділений з кДНК-клону вакцинного штаму SAD B19 RV.[ 38 ] Разом ці дані підтверджують припущення, що кінетика поглинання вірусу, яка є функцією RV G, є основним фактором, що визначає патогенність RV.
- Вірусні елементи, що беруть участь у поширенні та передачі вірусів
Унікальною властивістю вірусу сказу є його здатність поширюватися від клітини до клітини. Спостереження, що варіант Gln333 ERA втрачає pH-залежну активність міжклітинного злиття in vitro [ 39 ] та демонструє значно знижену здатність поширюватися від клітини до клітини [ 40 ], свідчить про те, що RV G також відіграє ключову роль у міжклітинному поширенні та, отже, у передачі вірусу, ймовірно, через свою фузіогенну активність. Ця можливість додатково підтверджується тим, що швидкість поширення патогенного ревертанта RV SPBNGAK майже вдвічі вища, ніж визначена для непатогенного варіанту SPBNGA. Цікаво, що мутація Asn 194 → Lys 194 у G SPBNGAK спричинила зсув порогу pH для мембранного злиття до вищого pH, що підтверджує гіпотезу про те, що вищий поріг pH для мембранного злиття пов'язаний зі збільшенням поширення вірусу. [ 41 ]
Дослідження транснейрональних індикаторів інфекції ротавірусу (РВ) у щурів [ 42 ] та макак-резусів [ 43 ] показали, що вірус сказу мігрує виключно в ретроградному напрямку в аксонах. Хоча кілька білків РВ беруть участь у механізмах нейронального транспорту, РВ G, здається, відіграє переважну роль у транснейрональному поширенні РВ-інфекції. Наприклад, хоча периферична інфекція вірусом інфекційної анемії коней (EIAV), псевдотипованим за допомогою RV G, призводить до перенесення вірусу в спинний мозок, той самий EIAV, псевдотипований за допомогою вірусу везикулярного стоматиту G, не зміг потрапити в нервову систему. [ 44 ] Крім того, було виявлено, що поширення вірусу мутанта ERA G Arg 333 → Gln 333 у ЦНС значно знижене порівняно з мутантом дикого типу, що додатково свідчить про функцію інтактного РВ G у транссинаптичному поширенні. Однак, найпереконливішим доказом важливої ролі RV G у транссинаптичному транспорті є внутрішньочерепне зараження мишей рекомбінантним G-дефіцитним вірусом RV, яке показало, що інфекція залишалася обмеженою нейронами в місці інокуляції без будь-яких ознак поширення на вторинні нейрони.[ 45 ] Однак, ймовірно, що, окрім RV G, RV M також відіграє певну роль у поширенні вірусу, а отже, і в транссинаптичному транспорті. У зв'язку з цим було показано, що поширення химерного варіанту RV SN-BMBG, який містить як M, так і G від високопатогенного SB, було значно вищим, ніж поширення химерних варіантів SN-BG або SN-BM, які містять G та M від SB відповідно, що свідчить про те, що оптимальна взаємодія M з G може відігравати важливу роль у поширенні вірусу між клітинами.[ 46 ] Оскільки RV M підтримує брунькування вірусу,[ 47 ] ймовірно, що більш ефективне поширення химерного варіанту RV SN-BMBG зумовлене оптимальним брунькуванням вірусу на постсинаптичній мембрані.
Недавні дослідження показали, що взаємодія між RV P та легким ланцюгом динеїну пов'язує RV RNP з транспортною системою клітини-хазяїна, тим самим сприяючи ретроградному аксональному транспорту вірусу.[ 48 ],[ 49 ] Однак периферичне інфікування дорослих мишей показало, що делеція LC8-зв'язуючого домену RV P не запобігає потраплянню вірусу в ЦНС, що свідчить про те, що RV білок не бере безпосередньої участі в ретроградному аксональному поширенні RV.[ 50 ]
- Вірусні елементи, що контролюють реплікацію вірусу
На відміну від багатьох інших вірусів, таких як вірус грипу, патогенність рабдовірусу обернено пропорційна швидкості синтезу вірусної РНК та продукування інфекційних вірусних частинок. Порівняння рівнів вірусної мРНК та геномної РНК, що продукуються різними химерними вірусами, свідчить про те, що транскрипція та реплікація вірусної РНК регулюються кількома факторами, включаючи RV M, який був ідентифікований як транс-активний фактор, що опосередковує перехід від початкових високих рівнів синтезу мРНК до синтезу геномної РНК.[ 51 ] Крім того, M з усіх рабдовірусів здатний пригнічувати експресію вірусних генів, зв'язуючись з RNP, що призводить до утворення висококонденсованої структури, подібної до каркасу, яка не здатна підтримувати синтез РНК.
Для ідентифікації інших вірусних елементів, що контролюють патогенність шляхом регуляції вірусної реплікації, 5'-кінцеві послідовності високопатогенного штаму SB були поступово замінені послідовностями з високоатенуйованого вакцинного штаму SN, що призвело до отримання рекомбінантних вірусів SB2 (кінцева послідовність [TS] + L), SB3 (TS + L + псевдоген [Ψ]), SB4 (TS + L + Ψ + G) та SB5 (TS + L + Ψ + G + M). Внутрішньом'язова інфекція батьківськими вірусами SB та SN та химерними RV SB2, SB3, SB4 та SB5 викликала найвищі показники смертності у SB-інфікованих мишей та відсутність захворюваності чи смертності у SN-інфікованих мишей. Заміна TS, L та SB відповідними елементами з SN призвела до помірного зниження захворюваності та смертності, а додатковий обмін G або G плюс M сильно зменшив або повністю усунув вірусну патогенність.
Фенотипова характеристика цих дикого типу та химерних ротавірусів (РВ) у культурі тканин показала, що патогенність даного РВ обернено корелює з його здатністю до реплікації в нейрональних клітинах. Хоча SB реплікувався на рівнях майже в 1000 разів нижчих, ніж SN, а заміна TS, L та в SB рівнями SN мала незначний вплив на кінетику росту вірусу, додаткова заміна G або G плюс M в SB відповідними генами SN призвела до збільшення продукції вірусу на 1 логарифм, що свідчить про те, що кінетика реплікації вірусної РНК, а також виробництво вірусних частинок значною мірою контролюються білком G РВ. Цей висновок підтверджується даними, отриманими з варіантами G РВ, які відрізняються однією амінокислотою в своїх G-білках. Патогенний варіант вірусу сказу SPBNGAK 194 продукував титр вірусу в клітинах NA, який був на 1 log нижчий, ніж титр, отриманий непатогенним варіантом SPBNGAN 194, а аналіз ПЛР у реальному часі показав, що швидкість транскрипції та реплікації вірусної РНК в клітинах NA, інфікованих SPBNGAK, була в 5 та 10 разів вищою, ніж в клітинах NA, інфікованих SPBNGAK.[ 52 ] Подальші докази зворотної кореляції між патогенністю та швидкістю синтезу вірусної РНК та продукцією вірусних частинок були надані мишами, інфікованими химерними рекомбінантними вірусами, у яких гени G та M атенуйованого штаму SN були замінені генами високопатогенного штаму SB. Ці експерименти виявили значне збільшення патогенності батьківського штаму SN, що ніс RV G, порівняно з патогенним штамом SB. Патогенність ще більше зростала, коли в SN були введені як G, так і M з SB.
Заміна G або M, або обох у SN відповідними генами з SB була пов'язана зі значним зниженням швидкості утворення вірусних частинок, а також швидкості синтезу вірусної РНК. Ці дані вказують на те, що як G, так і M відіграють важливу роль у патогенезі респіраторного вірусного інфекційного захворювання (РВ), регулюючи реплікацію вірусу. Виявлення того, що заміщення G або G плюс M у SN на G або G плюс M з SB призводить до помірного або сильного зниження транскрипції та реплікації вірусної РНК відповідно, тоді як заміщення окремо M у SN на M з SB призводить до сильного збільшення транскрипції та реплікації вірусної РНК, вказує на те, що РВ G також має важливу регуляторну функцію в транскрипції/реплікації вірусної РНК як самостійно, так і через взаємодію з білком M. Механізм, за допомогою якого ген РВ G контролює синтез вірусної РНК, невідомий. Певні нуклеотидні послідовності в генах РВ G, такі як ті, що включають кодони для Arg333 та Lys 194, були ідентифіковані як мішені для клітинних мікроРНК. Було показано, що розпізнавання мішеней клітинними мікроРНК може призвести до позитивної або негативної регуляції реплікації вірусу. [ 53 ] Заміни Arg 333 → Glu 333 або Lys 194 → Ser 194 у послідовності гена RV G призводять до скасування послідовностей-мішеней мікроРНК, що, у свою чергу, пов'язано зі значним збільшенням швидкості синтезу вірусної РНК [Faber M, Університет Томаса Джефферсона, Пенсильванія, США, неопубліковані дані], що свідчить про те, що мікроРНК клітин хазяїна також відіграють важливу роль у регуляції реплікації RV, як було показано для інших РНК-вірусів, включаючи вірус везикулярного стоматиту та HCV. [ 54 ], [ 55 ]
Регуляція реплікації вірусу, ймовірно, є одним із важливих механізмів, що беруть участь у патогенезі ротавірусу. Щоб уникнути імунної відповіді та зберегти цілісність нейронної мережі, патогенні штами ротавірусу, але не атенуйовані штами, можуть регулювати швидкість свого росту. Нижча швидкість реплікації, ймовірно, приносить користь патогенним штамам ротавірусу, зберігаючи нейрональну структуру, яку ці віруси використовують для досягнення ЦНС. Іншим поясненням нижчої швидкості реплікації патогенного ротавірусу є те, що для того, щоб уникнути раннього виявлення імунною системою хазяїна, вірус підтримує мінімальний рівень експресії своїх антигенів.
Зв'язок між експресією RV G, апоптозом та патогенністю
Загальновідомо, що штами вірусу вуличного сказу, які є значно більш патогенними, ніж штами, адаптовані до культури тканин, експресують дуже обмежений рівень G та не індукують апоптоз до пізніх стадій інфекційного циклу, що свідчить про те, що патогенність певного штаму вірусу обернено корелює з експресією RV G та здатністю індукувати апоптоз.[ 56 ] Прямі докази кореляції між рівнем експресії G та ступенем апоптозу були отримані з рекомбінантним RV SPBNGA-GA, який ніс два ідентичні гени G та надмірно експресував RV G.[ 57 ] Морфологічні дослідження нейрональних культур, інфікованих цим рекомбінантним RV, показали, що загибель клітин значно збільшувалася паралельно з надмірною експресією RV G, і що апоптоз є основним механізмом, що бере участь у смерті, опосередкованій RV G. Зокрема, зниження фарбування F-актином після інфекції SPBNGA-GA узгоджується з деполімеризацією актинових філаментів, індукованою апоптозом. Крім того, кількість TUNEL-позитивних ядер у нейронах, інфікованих SPBNGA-GA, була значно збільшена порівняно з неінфікованими та SPBNGA-інфікованими нейронами. Однак механізм, за допомогою якого ген RV G опосередковує процес апоптотичної сигналізації, залишається значною мірою невідомим. Було висловлено припущення, що експресія RV G вище певного порогу серйозно порушує клітинну мембрану. Дуже ймовірно, що апоптотичні клітини не швидко виводяться з ЦНС і тому зазнають вторинного некрозу. [ 58 ] З іншого боку, RV-інфекція, і зокрема надмірна експресія білка RV G, може призвести до піроптозу, шляху клітинної смерті, подібного до апоптозу, який, на відміну від апоптозу, включає активацію каспази 1 і тим самим призводить до некрозу. [ 59 ] Ступінь некрозу або піроптозу, індукованого RV-інфекцією, ймовірно, відіграє вирішальну роль в індукції противірусного імунітету. Хоча апоптотичні клітини зберігають цілісність своєї мембрани та не стимулюють вроджену імунну відповідь, некротичні клітини стають проникними та секретують ендогенні ад'юванти, які можуть викликати потужну вроджену імунну відповідь. [ 60 ]
Оскільки рівень апоптозу/некрозу корелює з імуногенністю ротавірусу, було висловлено припущення, що імуностимулюючий ефект апоптотичних/некротичних клітин, найімовірніше, сприяє формуванню захисної імунної відповіді. Отже, регуляція експресії рецептора G ротавірусу, ймовірно, є важливим фактором патогенезу сказу, оскільки вона забезпечує засоби для виживання та поширення патогенних варіантів ротавірусу в нервовій системі без явного пошкодження нейронів та викликаючи захисну імунну відповідь, яка запобігає інфекції.
Експресія RV G може регулюватися на рівні синтезу РНК, посттрансляційному рівні або на обох рівнях. Показано, що рівні RV G, що експресуються різними химерними варіантами RV, відображаються швидкістю синтезу вірусної РНК, що свідчить про те, що диференціальна регуляція експресії RV G цими варіантами є результатом варіацій швидкості транскрипції вірусної мРНК. Як і у випадку зі швидкістю транскрипції вірусної РНК, кількість RV G, що експресується цими варіантами, обернено корелює з вірусною патогенністю. З іншого боку, інфікування первинних нейрональних культур менш патогенним варіантом RV CVS-B2c призвело до чотирикратного вищого рівня G-білка, ніж інфекція високопатогенним варіантом CVS-N2c, незважаючи на синтез порівнянних рівнів G-мРНК в обох інфекціях. Експерименти з імпульсним переслідуванням показали, що вищі рівні G-білка в нейронах, інфікованих CVS-B2c, були значною мірою результатом нижчої швидкості деградації G-білка CVS-B2c порівняно з G-білком CVS-N2c. Однак механізм, який призводить до швидшої протеолітичної деградації G-білка CVS-N2c, залишається нез'ясованим.
Інкубаційний період сказу в середньому становить 30-90 днів. У разі масивного зараження через великі рани голови та обличчя він може бути скорочений до 12 днів. У рідкісних випадках інкубаційний період може тривати 1 рік і більше.
Спостерігається суворо послідовна зміна трьох періодів захворювання: продромального, збудження, паралічу.
Продромальний період починається з появи ниючого або тягнучого болю в місці укусу, а також болю по ходу нервів. В області рубця може виникати печіння, свербіж, іноді почервоніння та набряк. Пацієнт відчуває загальне нездужання, головний біль, нудоту. Відзначаються блювота, підвищення температури тіла до 37,5-38°C та симптоми прогресуючого психічного розладу: підвищена рефлекторна збудливість, незрозуміле відчуття тривоги, страху, меланхолії. Часто пацієнт пригнічений, загальмований, замкнутий у собі, відмовляється від їжі, погано спить, скаржиться на похмурі думки, лякаючі сни. Продромальний період триває 2-3 дні, іноді продовжується до 7 днів. Після закінчення цього періоду можуть виникати напади тривоги з короткочасним утрудненням дихання, відчуттям стиснення в грудях, що супроводжуються тахікардією та почастішанням дихання.
Період збудження відзначається появою гідрофобії: при спробі пити, а потім при вигляді води або нагадуванні про неї у пацієнта виникає судомний спазм глотки та гортані, під час якого він з криком викидає кухоль з водою, викидає вперед тремтячі руки, закидає голову та тіло. Шия витягнута, болісна гримаса спотворює обличчя, яке через спазм дихальних м'язів стає синюватим. Очі витріщаються, виражають страх, благають про допомогу, зіниці розширюються, вдих утруднений. На піку нападу можлива зупинка серця та дихання. Напад триває кілька секунд, після чого стан пацієнта ніби покращується. Згодом напади спазмів м'язів гортані та глотки можуть виникати навіть від руху повітря (аерофобія), яскравого світла (світлофобія) або гучного слова (акустикофобія). Напади супроводжуються психомоторним збудженням, під час якого пацієнт поводиться як «божевільний». Свідомість під час нападу затьмарена, але прояснюється в міжнападному періоді. У період збудження, через підвищений тонус симпатичної нервової системи, у пацієнтів спостерігається різке посилення слиновиділення (сіалорея) з неможливістю ковтати слину через спазм глоткових м'язів. Хворий розбризкує слину. У деяких пацієнтів можуть розвиватися ознаки менінгізму та навіть опістотонусу, часто спостерігаються судоми. При цьому спинномозкова рідина може не змінюватися, але у деяких пацієнтів може підвищуватися концентрація білка та збільшуватися кількість клітин за рахунок лімфоцитів.
Без адекватного лікування ознаки зневоднення посилюються, риси обличчя стають чіткішими, а маса тіла знижується. Температура тіла підвищується до високих значень. Можливі судоми. Тривалість стадії збудження становить близько 2-3 днів, рідко 4-5 днів. Летальний результат зазвичай настає під час одного з нападів. Рідко пацієнт доживає до третьої стадії захворювання.
У період паралічу пацієнт заспокоюється. Напади гідрофобії припиняються, пацієнт може пити та ковтати їжу, свідомість ясна. Однак, незважаючи на видиме благополуччя, наростають млявість, апатія, депресія, незабаром з'являються параліч кінцівок, тазові розлади, параліч черепних нервів. Температура тіла підвищується до 42-43 °C, артеріальний тиск падає, і до кінця першої доби настає смерть від паралічу серцево-судинного та дихального центрів.
У периферичній крові спостерігаються нейтрофільний лейкоцитоз, підвищення рівня гемоглобіну, еритроцитів та гематокриту.
Що турбує?
Клінічно розрізняють типові та атипові форми. До атипових форм належать усі випадки без збудження та гідрофобії. До атипових форм належать бульбарна, мозочкова, менінгоенцефалітична тощо.
Виявлення антигену сказу, антитіл, вірусної РНК або виділення вірусу дозволяє діагностувати сказ. Оскільки будь-який окремий тест може бути негативним у пацієнта зі сказом, іноді необхідні серійні зразки сироватки крові для виявлення антитіл до сказу, зразки слини для вірусного посіву та біопсія шкіри для прямого імунофлуоресцентного тестування на вірусний антиген, особливо за наявності високої підозри на сказ.
Одним із найшвидших методів діагностики присмертного сказу у людей є проведення прямого імунофлуоресцентного тесту на біопсії шкіри потилиці для виявлення антигену сказу. Прямий імунофлуоресцентний тест є найчутливішим і найспецифічнішим методом виявлення антигену сказу в шкірі та інших свіжих тканинах (наприклад, біопсія мозку), хоча результати іноді можуть бути негативними на ранніх стадіях захворювання. Якщо свіжа тканина недоступна, ферментативне розщеплення фіксованих тканин може підвищити реактивність імунофлуоресцентного тесту; однак чутливість може бути неприйнятно низькою.
Діагноз також можна встановити, якщо вірус виділено зі слини після інокуляції клітин нейробластоми або лабораторних гризунів; зазвичай це найефективніше протягом перших 2–3 тижнів хвороби. Виявлення нейтралізуючих антитіл до вірусу сказу, яке зазвичай проводиться за допомогою швидкого флуоресцентного фокусного гальмування (RFFIT), у сироватці крові невакцинованих осіб також є діагностичним. Наявність антитіл у спинномозковій рідині підтверджує діагноз, але вони можуть з'явитися на 2–3 дні пізніше, ніж антитіла в сироватці крові, і тому можуть бути менш корисними на ранніх стадіях захворювання. Хоча серологічна відповідь після вакцинації загалом не відрізняється від серологічної відповіді, викликаної хворобою, вакцинація зазвичай не виробляє антитіл до спинномозкової рідини.
Лише сім випадків «одужання» від сказу за останні 25 років були добре задокументовані. Хоча вірус сказу не був виділений у жодного з пацієнтів, високі титри антитіл, що нейтралізують сказ, у зразках сироватки крові та наявність нейтралізуючих антитіл у спинномозковій рідині переконливо підтверджували діагноз.
Що потрібно обстежити?
Які аналізи необхідні?
Діагноз сказу у людей зазвичай ставиться на основі епідеміологічних та клінічних даних і підтверджується лабораторно. Діагноз є простим, якщо в анамнезі є укуси тварин і спостерігається повний спектр симптомів і ознак. В іншому випадку, перед проведенням специфічних лабораторних тестів необхідна ретельна, але швидка оцінка епідеміологічних та клінічних особливостей менш типових випадків. Будь-якого пацієнта з неврологічними ознаками або симптомами або нез'ясованим енцефалітом слід розпитати про можливість контакту з тваринами в ендемічних щодо сказу районах у країні проживання або за її межами. Неможливість підозрювати сказ у кількох нещодавніх смертях людей у Сполучених Штатах могла бути пов'язана з відсутністю ретельного анамнезу контакту.
На початку захворювання сказ може імітувати багато інфекційних та неінфекційних захворювань. Багато інших енцефалітів, таких як ті, що викликаються герпесвірусами та арбовірусами, нагадують сказ. Інші інфекційні захворювання також можуть імітувати сказ, такі як правець, церебральна малярія, рикетсіоз та черевний тиф. Паралітичні інфекційні захворювання, які можна сплутати зі сказом, включають поліомієліт, ботулізм та герпетичний мавпячий енцефаліт B.
Неінфекційні захворювання, які можна сплутати зі сказом, включають низку неврологічних синдромів, особливо гостру запальну полінейропатію (синдром Гійєна-Барре), а також алергічний поствакцинальний енцефаломієліт, що виникає внаслідок вакцинації проти сказу в нервову тканину, отруєння або наркотичного сп'яніння, алкогольної абстиненції, гостру порфірію та істерію, спричинену сказом. Синдром Гійєна-Барре можна сплутати з паралітичним сказом і навпаки.
Лікування сказу не розроблено. Введення великих доз специфічного антирабічного імуноглобуліну та лейкоцитарного інтерферону неефективне. Для полегшення страждань пацієнта проводиться симптоматичне лікування. Для цього пацієнта розміщують в окрему палату або бокс, створюють захисний режим, що обмежує вплив зовнішнього середовища (зниження шуму, яскравого світла, потоку повітря). Для зниження збудливості центральної нервової системи призначають снодійні, протисудомні та знеболювальні препарати. Нормалізується водний баланс.
У паралітичній стадії призначають препарати, що стимулюють діяльність серцево-судинної та дихальної систем. Рекомендується використовувати гіпербаричну оксигенацію, церебральну гіпотермію, контрольоване штучне дихання з повною кураризацією пацієнта. Однак усі методи лікування практично неефективні. У найкращому випадку вдається продовжити життя пацієнта на кілька місяців. Несприятливий результат зумовлений тяжкістю ураження стовбура мозку з руйнуванням життєво важливих центрів.
Розробка Пастером першої вакцини проти сказу в 1885 році започаткувала еру набагато ефективнішої боротьби зі сказом. Сьогодні, незважаючи на майже 100% рівень смертності людей від сказу, цьому захворюванню можна повністю запобігти за допомогою до- та/або постконтактної вакцинації. Хоча Пастер та його колеги започаткували вакцинацію приватних собак у Парижі, перша масова вакцинація собак була проведена на початку 1920-х років у Японії, що стало першою великою національною програмою боротьби зі сказом. Пероральна вакцинація диких тварин, вперше розроблена в 1970-х роках, з того часу неодноразово демонструвала ефективність контролю над хворобою у основних наземних господарів, таких як лисиці, єноти та скунси.[ 68 ] Тривала вакцинація проти сказу резервуарних видів тварин з рівнем охоплення 70% або вище зрештою знищить вірус сказу від резервуарних видів та запобіжить поширенню вірусу на випадкових господарів.[ 69 ]
Філогенетичні дані свідчать про те, що ліссавіруси інфікували кажанів задовго до того, як вони інфікували наземних ссавців, і більшість ліссавірусів, включаючи RABV, досі циркулюють у різних видах кажанів по всьому світу.[ 70 ] Однак ефективні методи запобігання передачі RABV серед кажанів залишаються невловимими, що виключає можливість повного викорінення сказу на даний момент. Однак, навіть після контакту з RABV через укус інфікованого ссавця, безпечна та ефективна постконтактна профілактика (ПЕП, включаючи очищення ран, імуноглобулін проти сказу та вакцинацію проти сказу) може захистити людей від зараження сказом, якщо лікування проводиться негайно та відповідно до рекомендацій Всесвітньої організації охорони здоров'я (ВООЗ).
Ці два методи запобігання смертності людей — один заснований на вакцинації людей, які зазнали впливу вірусу, а інший — на вакцинації достатньої кількості собак, щоб розірвати цикл передачі у джерелі — є основою підходу «єдиного здоров’я» до профілактики та боротьби зі сказом у собак. Ці два різні способи запобігання смертності людей розглядалися як окремі альтернативи: Стратегія А, заснована на забезпеченні постконтактної профілактичної допомоги людям, та Стратегія Б, заснована на вакцинації собак; або як компоненти комбінованої Стратегії А + Б в аналізі ймовірних витрат на альтернативні стратегії.[ 71 ]
Такі країни, як Таїланд, досягли величезного успіху в запобіганні смертності людей завдяки використанню постконтактної вакцинації (ПЕП), але також виявили зростання попиту та пов'язаних з цим витрат, пов'язаних лише з використанням ПЕП. [ 72 ] Наприклад, порівняно з ситуацією 1991 року, у 2003 році ПЕП потребувало в чотири рази більше людей (понад 400 000). Нещодавні дані показують, що Китайська Народна Республіка, яка вакцинує 15 мільйонів людей на рік після потенційного зараження сказом, витрачає близько 650 мільйонів доларів США на рік лише на ПЕП. [ 73 ]
Набагато більш сталий підхід полягає у запобіганні поширенню інфекції в джерелі, серед тварин, одночасно збільшуючи доступ до постконтактної вакцинації (ПЕП) для пацієнтів-людей, які зазнали впливу інфекції, коли це необхідно. Там, де є політична воля та достатнє фінансування для боротьби зі сказом у собак, смертельні випадки можуть бути усунені та вже були усунені. Широке використання вакцинації собак призвело до ліквідації сказу у собак у кількох країнах, включаючи Малайзію в 1954 році, [ 74 ] Японію в 1956 році, Тайвань в 1961 році, Сінгапур і, зокрема, по всій Західній Європі (огляд у Rupprecht et al., King et al., а також Gongal and Wright). [ 75 ]

 [
[