Медичний експерт статті
Нові публікації
Звичне невиношування вагітності - Причини
Останній перегляд: 04.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
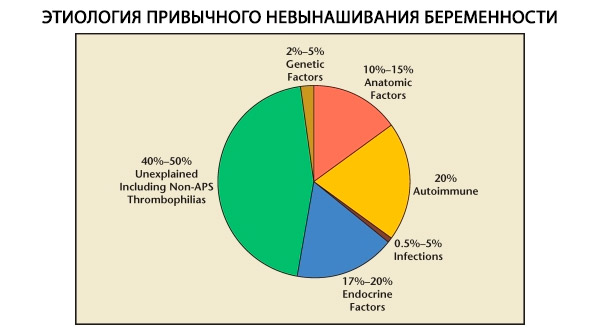
У структурі звичних невиношування вагітності виділяють генетичні, анатомічні, ендокринні, імунологічні та інфекційні фактори. При виключенні всіх вищезазначених причин залишається група пацієнток, у яких походження звичного невиношування неясне (ідіопатичні невиношування). За даними К. Кулама та ін. (1996), 80% ідіопатичних невиношування вагітності мають основу в нерозпізнаних імунних порушеннях.
Немає переконливих доказів того, що ендометріоз спричиняє звичні викидні, або що медикаментозне чи хірургічне лікування ендометріозу зменшує частоту звичкових викиднів.
Згідно з сучасними уявленнями, окрім генетичних та частково інфекційних причин, що призводять до формування аномального ембріона, реалізація шкідливої дії інших факторів (анатомічних, ендокринних, імунологічних) полягає у створенні несприятливого фону для розвитку генетично повноцінної заплідненої яйцеклітини, що призводить до виснаження резервних можливостей хоріона та припинення розвитку (ембріогенезу). Критичними періодами в першому триместрі вагітності визнаються 6-8 тижнів (загибель ембріона) та 10-12 тижнів (вигнання заплідненої яйцеклітини).
 [ 1 ]
[ 1 ]
Генетичні причини звичного невиношування вагітності
Генетичні фактори становлять 3–6% причин звичних невиношування вагітності. При спорадичному перериванні вагітності в першому триместрі близько 50% абортів мають хромосомні аномалії. Більшість з них (95%) – це зміни кількості хромосом – моносомія (втрата однієї хромосоми), трисомія (наявність додаткової хромосоми), які є результатом помилок мейозу, а також поліплоїдія (збільшення хромосомного складу на повний гаплоїдний набір), що виникає при заплідненні яйцеклітини двома або більше сперматозоїдами. При спорадичних невиношуваннях найчастіше зустрічається трисомія – 60% усіх мутацій (найчастіше на 16-й хромосомі, а також 13, 18, 21, 22), на другому місці за частотою знаходиться синдром Шерешевського-Тернера (хромосома 45 X0) – 20%, решта 15% припадають на поліплоїдію (особливо триплоїдію).
У разі зміни кількості хромосом при аборті дослідження каріотипу батьків найчастіше не виявляє жодної патології, а ймовірність хромосомного захворювання плода під час наступної вагітності становить 1%. Натомість, при дослідженні абортів у пар зі звичним невиношуванням вагітності структурні зміни хромосом (внутрішньо- та міжхромосомні) спостерігаються у 3-6% випадків. При дослідженні каріотипу батьків збалансовані хромосомні перебудови виявляються у 7% випадків. Найчастіше це реципрокні транслокації, при яких сегмент однієї хромосоми розташований на місці іншого сегмента негомологічної хромосоми, а також мозаїцизм статевих хромосом, інверсія та виявлення хромосом у формі кільця. У разі наявності таких перебудов у одного з подружжя процеси спарювання та роз'єднання хромосом під час мейозу утруднені, що призводить до втрати (делеції) або подвоєння (дуплікації) ділянок хромосом у гаметах. Це призводить до так званих незбалансованих хромосомних перебудов, при яких ембріон або нежиттєздатний, або служить носієм тяжкої хромосомної патології. Ймовірність народження дитини з незбалансованими хромосомними аномаліями за наявності збалансованих хромосомних перебудов у каріотипі одного з батьків становить 1–15%. Розбіжності в даних пов'язані з характером перебудов, розміром задіяних сегментів, статтю носія та сімейним анамнезом.
Діагностика
Анамнез
- Спадкові захворювання у членів сім'ї.
- Наявність вроджених аномалій у родині.
- Народження дітей із затримкою розумового розвитку.
- Наявність безпліддя та/або викидня невідомого походження у подружньої пари або у родичів.
- Наявність нез'ясованих випадків перинатальної смертності.
Спеціальні методи дослідження
- Дослідження каріотипу батьків особливо показане подружнім парам при народженні новонародженого з вадами розвитку на додаток до невиношування вагітності в анамнезі, а також у випадках звичного невиношування вагітності на ранніх термінах.
- Цитогенетичний аналіз абортів у випадках мертвонародження або неонатальної смертності.
Показання для консультації з іншими спеціалістами
Якщо у батьків виявлені зміни каріотипу, необхідна консультація генетика для оцінки ступеня ризику народження дитини з патологією або, за необхідності, вирішення питання про донорство яйцеклітини або сперматозоїда.
Подальше ведення пацієнта
Якщо у подружжя виявлено патологічний каріотип, навіть у одного з батьків, рекомендується провести пренатальну діагностику під час вагітності – біопсію хоріона або амніоцентез – через високий ризик порушень розвитку плода.
Анатомічні причини звичного невиношування вагітності
Анатомічні причини звичного невиношування вагітності включають:
- вроджені аномалії розвитку матки (повне подвоєння матки; дворога, сідлоподібна, однорога матка; часткова або повна внутрішньоматкова перегородка);
- набуті анатомічні дефекти;
- внутрішньоматкові спайки (синдром Ашермана);
- субмукозні фіброміоми матки;
- істміко-цервікальна недостатність.
Частота анатомічних аномалій у пацієнток зі звичним невиношуванням вагітності коливається від 10 до 16%. Частота виникнення вад розвитку матки, які можуть призвести до викидня (але не безпліддя), стосовно всіх вад розвитку матки така: дворога матка – 37%, сідлоподібна матка – 15%, внутрішньоматкова перегородка – 22%, повне подвоєння матки – 11%, однорога матка – 4,4%.
Діагностика звичного невиношування вагітності
Анамнез
При анатомічній патології матки частіше спостерігаються пізні переривання вагітності та передчасні пологи, проте при імплантації на внутрішньоматковій перегородці або поблизу міоматозного вузла можливі також і дострокові переривання вагітності.
Для істміко-цервікальної недостатності патогномонічним ознакою є спонтанне переривання вагітності у другому триместрі або ранні передчасні пологи, які відбуваються відносно швидко та з незначним болем.
При вадах розвитку матки необхідно звертати увагу на анамнестичні вказівки на патологію сечовивідних шляхів (часто супроводжує вроджені аномалії матки) та характер розвитку менструальної функції (вказівки на гематометру при функціонуючому рудиментарному розі матки).
Спеціальні методи обстеження
- Наразі для встановлення діагнозу проводиться гістеросальпінгографія, яка дозволяє вивчити форму порожнини матки, виявити наявність субмукозних фібром, спайок, перегородок та визначити прохідність маткових труб. Для діагностики патології матки раціонально проводити гістеросальпінгографію в період між менструацією та овуляцією, тобто в першій фазі менструального циклу після припинення кров'янистих виділень (7-9-й день циклу). Для діагностики істміко-цервікальної недостатності дослідження проводиться у другій фазі менструального циклу (18-20-й день) з метою визначення стану внутрішнього зіву шийки матки. Перед проведенням гістеросальпінгографії необхідно виключити запальні захворювання органів малого тазу або провести їх лікування.
- Гістероскопія набула широкого поширення в останні роки та стала золотим стандартом діагностики внутрішньоматкової патології. Однак, через вищу вартість порівняно з гістеросальпінгографією, метод застосовується у жінок з вказівкою на внутрішньоматкову патологію на основі попередніх даних ультразвукового дослідження. Гістероскопію можна використовувати для огляду порожнини матки, визначення характеру внутрішньоматкової патології, а також, за наявності необхідного обладнання (резектоскопа), проведення малоінвазивного хірургічного лікування – видалення спайок, субмукозних міоматозних вузлів, поліпів ендометрію. При видаленні внутрішньоматкової перегородки перевага надається гістерорезектоскопії з лапароскопічним контролем, що запобігає можливості перфорації стінки матки.
- Ультразвукове дослідження проводиться в першій фазі менструального циклу, що дозволяє поставити попередній діагноз субмукозної міоми матки, внутрішньоматкових спайок, а в другій фазі циклу – виявити внутрішньоматкову перегородку та дворогу матку. Цей метод має особливе значення на ранніх термінах вагітності, коли його чутливість у діагностиці цих станів становить 100%, а специфічність – 80%. Поза вагітністю діагноз потребує додаткового підтвердження іншими методами.
- Зарубіжні автори вказують на перевагу соногістерографії (ультразвукове дослідження за допомогою трансвагінального датчика з попереднім введенням 0,9% розчину натрію хлориду в порожнину матки) над гістеросальпінгографією, оскільки вона дозволяє провести диференціальну діагностику між внутрішньоматковою перегородкою та дворогою маткою. За допомогою соногістерографії можна не тільки вивчити форму порожнини матки, але й визначити конфігурацію дна тіла матки. У нашій країні цей метод не набув поширення.
- У деяких складних випадках для верифікації діагнозу використовується МРТ органів малого тазу. Метод дозволяє отримати цінну інформацію у разі аномалій розвитку матки, що супроводжуються атиповим розташуванням органів у малому тазу. МРТ важлива у разі рудиментарного рогу матки для вирішення питання про доцільність його видалення. Необхідність видалення рудиментарного рогу матки виникає у разі його з'єднання з трубою та яєчником, щоб запобігти формуванню та розвитку в ньому заплідненої яйцеклітини. Переривання вагітності при анатомічних аномаліях матки може бути пов'язане з невдалою імплантацією заплідненої яйцеклітини (на внутрішньоматковій перегородці, поблизу підслизового міоматозного вузла), недостатньо розвиненою васкуляризацією та рецепцією ендометрію, тісними просторовими взаємовідносинами в порожнині матки (наприклад, при деформації порожнини міоматозним вузлом), що часто супроводжується ІЦН, та гормональними порушеннями.
Лікування звичного невиношування вагітності
Хірургічне лікування
За наявності внутрішньоматкової перегородки, субмукозних міоматозних вузлів та спайок найефективнішим хірургічним лікуванням є гістерорезектоскопія. Частота подальших викиднів у цій групі жінок після лікування становить 10% порівняно з 90% до операції. При порівнянні результатів метропластики, виконаної за допомогою лапаротомії та трансцервікальної гістерорезектоскопії, П. Хейнонен (1997) отримав результати, що свідчать про меншу травматичність та більшу ефективність гістерорезектоскопії; відсоток вагітностей, що призвели до народження життєздатних дітей, становив 68 та 86% відповідно.
Хірургічне видалення внутрішньоматкової перегородки, спайок та субмукозних міоматозних вузлів виключає викидень у 70–80% випадків. Однак воно неефективне у жінок з вадами розвитку матки, які мали нормальні пологи з подальшими звичними викиднями. Цілком ймовірно, що в таких випадках анатомічний фактор не є провідною причиною, і необхідно шукати інші причини викидня.
Доведено, що абдомінальна метропластика пов'язана зі значним ризиком післяопераційного безпліддя та не покращує прогноз подальшої вагітності. Тому перевагу краще віддавати гістероскопії та лапароскопічним операціям.
Лікування медикаментами
Ефективність введення ВМС, високих доз естрогенних препаратів, введення катетера Фолея в порожнину матки після операцій з видалення спайок, внутрішньоматкової перегородки не доведена. Рекомендується планувати вагітність не раніше ніж через 3 місяці після операції. Для покращення росту ендометрію циклічна гормональна терапія проводиться протягом 3 менструальних циклів [14]. Протягом 3 місяців у перші 14 днів циклу доцільно приймати препарат, що містить 2 мг 17-бета-естрадіолу, у наступні 14 днів – 2 мг 17-бета-естрадіолу та 20 мг дидрогестерону (10 мг дидрогестерону у складі комбінованого препарату плюс 10 мг дидрогестерону в окремій таблетованій формі).
Подальше ведення пацієнта
Особливості перебігу вагітності при двороговій матці або подвоєнні матки (коли є 2 порожнини матки):
- на ранніх термінах вагітності кровотеча часто виникає з «порожнього» рогу або порожнини матки через виражену децидуальну реакцію; тактика в цьому випадку повинна бути консервативною та полягати у використанні спазмолітичних та кровоспинних засобів;
- загроза переривання вагітності на різних термінах;
- розвиток істміко-цервікальної недостатності;
- затримка внутрішньоутробного розвитку, спричинена плацентарною недостатністю.
На ранніх термінах вагітності, у разі кровотечі, доцільний постільний та напівпостільний режим, а також призначення кровоспинних, спазмолітичних та седативних препаратів, терапія гестагенами (дидрогестерон у добовій дозі від 20 до 40 мг) до 16–18 тижнів вагітності.
Ендокринні причини звичного невиношування вагітності
За даними різних авторів, ендокринні причини невиношування вагітності становлять від 8 до 20%. Найбільш значущими з них є дефіцит лютеїнової фази (ДЛФ), гіперсекреція ЛГ, дисфункція щитовидної залози та цукровий діабет.
Тяжке захворювання щитовидної залози або цукровий діабет можуть призвести до повторних викиднів. Однак при компенсованому цукровому діабеті ризик звичних викиднів не відрізняється від ризику в загальній популяції.
Водночас, висока частота гіпотиреозу в популяції вимагає проведення скринінгу з вимірюванням рівня ТТГ. У пацієнток зі звичним невиношуванням вагітності недостатність лютеїнової фази спостерігається у 20–60% випадків, а ультразвукові ознаки полікістозу яєчників – у 44–56%. Згідно з літературними даними, вплив індивідуальних гормональних порушень на формування симптомокомплексу звичного невиношування залишається суперечливим. Дослідження М. Огасавари та ін. (1997) не виявили достовірних відмінностей у частоті переривання вагітності з ЛПІ та без нього у пацієнток з двома або більше попередніми невиношуваннями в анамнезі, виключаючи аутоімунні, анатомічні та інфекційні причини.
Недостатність функції жовтого тіла може бути результатом низки несприятливих факторів:
- порушення секреції ФСГ та ЛГ у першій фазі менструального циклу;
- ранній або, навпаки, занадто пізній пік вивільнення ЛГ;
- гіпоестрогенізм як наслідок неадекватного фолікулогенезу. Усі ці стани не підлягають корекції замісною терапією гестагенними препаратами в постовуляторному періоді. Проспективні дослідження, проведені Л. Ріган та ін., показали значне збільшення частоти викиднів у пацієнток з гіперсекрецією ЛГ на 8-й день менструального циклу порівняно з жінками з нормальним рівнем ЛГ у крові (65% та 12% викиднів відповідно). Шкідливий вплив несвоєчасного сплеску ЛГ пов'язаний з передчасним відновленням другого мейотичного поділу та овуляції незрілої яйцеклітини, а також з індукцією продукції андрогенів тека-клітинами поряд з порушенням рецепції ендометрію під впливом недостатності гестагенів. Однак попереднє зниження преовуляторного рівня ЛГ агоністами гонадотропін-рилізинг-гормону без додаткових заходів, спрямованих на пролонгування наступної вагітності, не забезпечує очікуваного зниження частоти викиднів.
Золотим стандартом діагностики НЛФ є гістологічне дослідження матеріалу, отриманого в результаті біопсії ендометрія у другій фазі циклу протягом 2 менструальних циклів.
Діагностика інших причин овуляторної дисфункції, таких як гіперпролактинемія, гіпотиреоз, функціональний надлишок андрогенів (яєчників або наднирників), повинна супроводжуватися призначенням відповідного лікування.
Діагностика
Анамнез та фізикальне обстеження
- Анамнез. Фактори, які слід враховувати: пізня менархе, нерегулярний менструальний цикл (олігоменорея, аменорея, раптове збільшення ваги, втрата ваги, безпліддя, звичні викидні на ранніх термінах).
- Обстеження: тип статури, зріст, маса тіла, гірсутизм, вираженість вторинних статевих ознак, наявність стрій, обстеження молочних залоз на галакторею.
- Функціональні діагностичні тести: вимірювання ректальної температури протягом 3 менструальних циклів.
Спеціальні методи дослідження
- Гормональне дослідження:
- у 1-й фазі менструального циклу (7–8-й день) – визначення вмісту ФСГ, ЛГ, пролактину, ТТГ, тестостерону, 17-гідроксипрогестерону (17-ОП), ДГЕАС;
- у 2-й фазі менструального циклу (21–22 дні) – визначення вмісту прогестерону (нормативні показники рівня прогестерону дуже мінливі, метод не можна використовувати без урахування інших факторів).
- Ультразвукове дослідження:
- у 1-й фазі менструального циклу (5–7-й день) – діагностика патології ендометрію, полікістозу яєчників;
- у 2-й фазі менструального циклу (20–21 день) – вимірювання товщини ендометрію (норма 10–11 мм, корелює з вмістом прогестерону).
- Біопсію ендометрію для перевірки НЛФ проводять за 2 дні до очікуваної менструації (на 26-й день при 28-денному циклі). Цей метод використовується у випадках, коли діагноз неясний. Для вивчення змін ендометрію в так званий період «імплантаційного вікна» біопсію проводять на 6-й день після овуляції.
Лікування
При діагностиці НЛФ (за даними ректальних температурних діаграм тривалість 2-ї фази менше 11 днів, спостерігається ступінчасте підвищення температури, недостатня секреторна трансформація ендометрію за даними біопсії ендометрію, низький рівень прогестерону в сироватці крові) необхідно виявити причину таких порушень.
Якщо НЛФ супроводжується гіперпролактинемією, проводиться МРТ головного мозку. Альтернативним методом є рентген черепа (область турецького сідла).
Першим етапом при гіперпролактинемії є виключення аденоми гіпофіза, що потребує хірургічного лікування. За відсутності суттєвих змін гіперпролактинемію вважають функціональною, і для нормалізації рівня пролактину призначають лікування бромокриптином. Початкова доза бромокриптину становить 1,25 мг/добу протягом 2 тижнів, після контролю рівня пролактину, якщо показники не нормалізуються, дозу збільшують до 2,5 мг/добу. При значному підвищенні рівня пролактину початкова доза становить 2,5 мг/добу. Якщо настала вагітність, прийом бромокриптину слід припинити.
Якщо виявлено гіпотиреоз, характер патології щитоподібної залози визначається разом з ендокринологом. У будь-якому випадку показана щоденна терапія левотироксином натрію, доза підбирається індивідуально до нормалізації рівня ТТГ. Якщо настала вагітність, лікування левотироксином натрію слід продовжувати. Питання про доцільність збільшення дози в першому триместрі вагітності вирішується разом з ендокринологом після отримання результатів гормонального обстеження (рівень ТТГ, вільний тироксин).
Корекція НЛФ проводиться одним із двох способів. Перший спосіб – стимуляція овуляції, другий спосіб – замісна терапія препаратами прогестерону.
Першим варіантом лікування є стимуляція овуляції кломіфену цитратом. Цей метод лікування базується на тому, що більшість порушень лютеїнової фази закладаються у фолікулярній фазі циклу. Постійно знижений рівень прогестерону у 2-й фазі є наслідком порушення фолікулогенезу в 1-й фазі циклу. Це порушення буде виправлено з більшим успіхом низькими дозами кломіфену цитрату на початку фолікулярної фази, ніж призначенням прогестерону у 2-й фазі циклу.
У 1-му циклі доза кломіфену цитрату становить 50 мг/добу з 5-го по 9-й день менструального циклу. Ефективність контролюється за допомогою ректальних температурних діаграм, вимірювання рівня прогестерону у 2-й фазі циклу або динамічного ультразвукового дослідження. Якщо у 2-му циклі стимуляції овуляції достатнього ефекту немає, дозу кломіфену цитрату слід збільшити до 100 мг/добу з 5-го по 9-й день циклу. Максимально можлива доза у 3-му циклі стимуляції овуляції становить 150 мг/добу. Таке збільшення дози можливе лише за умови гарної переносимості препарату (відсутність інтенсивного болю внизу живота та попереку та інших ознак гіперстимуляції яєчників).
Другий варіант лікування: замісна терапія препаратами прогестерону, які сприяють повній секреторній трансформації ендометрію, що дає необхідний ефект у пацієнток зі звичним невиношуванням вагітності зі збереженою овуляцією. Крім того, в останні роки встановлено, що призначення препаратів прогестерону має не тільки гормональний, але й імуномодулюючий ефект, пригнічуючи реакції відторгнення з боку імунокомпетентних клітин ендометрію. Зокрема, подібний ефект описано для дигідрогестерону в дозі 20 мг/добу. З метою замісної терапії дидрогестерон застосовують у дозі 20 мг/добу перорально або мікронізований прогестерон вагінально у дозі 200 мг/добу. Лікування проводять на 2-й день після овуляції (наступний день після підвищення ректальної температури) і продовжують протягом 10 днів. Якщо вагітність настала, лікування препаратами прогестерону слід продовжувати.
Сучасні дослідження не підтвердили ефективність хоріонічного гонадотропіну людини в лікуванні звичного невиношування вагітності.
При гіперандрогенії (оваріального або надниркового генезу) у пацієнток зі звичним невиношуванням вагітності показане медикаментозне лікування через вплив андрогенів на повноту овуляції та стан ендометрію. У разі порушення біосинтезу надниркових андрогенів можливий їх вірилізуючий вплив на плід жіночої статі, тому стероїдна терапія проводиться в інтересах плода.
Гіперандрогенія яєчникового генезу (полікістоз яєчників)
Анамнез, результати фізикального огляду та спеціального обстеження
- В анамнезі: пізня менархе, порушення менструального циклу, такі як олігоменорея (зазвичай первинна, рідше вторинна). Вагітності трапляються рідко, зазвичай спонтанно перериваються в першому триместрі, з тривалими періодами безпліддя між вагітностями.
- Обстеження: гірсутизм, акне, розтяжки, високий індекс маси тіла (за бажанням).
- Графіки ректальної температури: ановуляторні цикли чергуються з циклами з овуляцією та НЛФ.
- Гормональне обстеження: високий рівень тестостерону, можливе підвищення рівня ФСГ та ЛГ, співвідношення ЛГ/ФСГ більше 3. УЗД: полікістоз яєчників.
Лікування
Немедикаментозне лікування
Схуднення – дієтотерапія, фізична активність.
Лікування медикаментами
- Орлістат у дозі 120 мг з кожним основним прийомом їжі. Тривалість курсу визначається з урахуванням ефекту та переносимості.
- Попереднє зниження рівня тестостерону препаратами, що містять ципротерону ацетат (2 мг) та ЕЕ (35 мкг) протягом 3 менструальних циклів.
- Припинення прийому контрацептивів, гормональна підтримка другої фази циклу (гестагенна терапія) – дидрогестерон у дозі 20 мг/добу з 16-го по 25-й день менструального циклу. Якщо спонтанної овуляції немає, переходити до наступного етапу.
- Стимуляція овуляції кломіфену цитратом у початковій дозі 50 мг/добу з 5-го по 9-й день менструального циклу з одночасною терапією гестагенами (дидрогестерон у дозі 20 мг/добу з 16-го по 25-й день циклу) та дексаметазоном (0,5 мг).
- За відсутності вагітності дозу кломіфену цитрату збільшують до 100–150 мг/добу з призначенням гестагенів у другій фазі циклу та дексаметазону (0,5 мг). Встановлено, що, хоча дексаметазон знижує лише рівень надниркових андрогенів, овуляція та зачаття відбуваються значно частіше при лікуванні кломіфену цитратом та дексаметазоном, ніж при застосуванні лише кломіфену цитрату [12].
- Проводяться три цикли стимуляції овуляції, після чого рекомендується перерва з трьох менструальних циклів з гестагенною підтримкою та рішення про хірургічне лікування з використанням лапароскопічного доступу (клиноподібна резекція яєчників, лазерна вапоризація).
Подальше ведення пацієнта
Ведення вагітності повинно супроводжуватися гестагенною підтримкою до 16 тижнів вагітності (дидрогестерон у дозі 20 мг/добу або мікронізований прогестерон у дозі 200 мг/добу), дексаметазон призначається лише у першому триместрі вагітності. Обов'язковий моніторинг для своєчасної діагностики істміко-цервікальної недостатності та, за необхідності, її хірургічної корекції.
Гіперандрогенія надниркових залоз (пубертатний та постпубертатний адреногенітальний синдром)
Адреногенітальний синдром (АГС) – спадкове захворювання, пов’язане з порушенням синтезу гормонів кори надниркових залоз внаслідок пошкодження генів, відповідальних за синтез низки ферментних систем. Захворювання успадковується за аутосомно-рецесивним типом з передачею мутантних генів від обох батьків, які є здоровими носіями.
У 90% випадків адреногенітальний синдром викликаний мутаціями в гені CYP21B, що призводять до порушення синтезу 21-гідроксилази.
Анамнез, результати фізикального огляду та спеціального обстеження
- В анамнезі: пізня менархе, незначно подовжений менструальний цикл, можлива олігоменорея, спонтанні викидні в першому триместрі, можливе безпліддя.
- Обстеження: акне, гірсутизм, андроїдний тип статури (широкі плечі, вузький таз), гіпертрофія клітора.
- Графіки ректальної температури: ановуляторні цикли чергуються з циклами з овуляцією та НЛФ.
- Гормональна проба: високий рівень 17-ОП, ДГЕАС.
- УЗД: яєчники не змінені.
Патогномонічна ознака поза вагітністю – підвищення концентрації 17-ОП у плазмі крові.
Наразі для діагностики латентної, некласичної форми надниркової гіперандрогенії використовується тест з АКТГ. Для цього тесту використовується Синактен – синтетичний поліпептид, який має властивості ендогенного АКТГ, тобто стимулює початкові фази синтезу стероїдних гормонів з холестерину в надниркових залозах.
Синактенова проба (аналог АКТГ): 1 мл (0,5 мг) синактену вводять підшкірно в плече, початковий вміст 17-ОП та кортизолу спочатку визначають у ранковому 9-годинному зразку плазми крові. Контрольний зразок крові береться через 9 годин після ін'єкції для визначення рівня 17-ОП та кортизолу. Потім розраховують індекс визначення (D) за формулою:
D = 0,052 × 17-ОП + 0,005 × Кортизол/17-ОП - 0,018 × Кортизол/17-ОП
Якщо коефіцієнт D менше або дорівнює 0,069, це свідчить про відсутність надниркової гіперандрогенії. Якщо коефіцієнт D більше 0,069, слід вважати, що гіперандрогенія спричинена порушенням функції надниркових залоз.
Лікування медикаментами
Основним методом лікування гіперандрогенії, спричиненої дефіцитом 21-гідроксилази, є глюкокортикоїди, які використовуються для пригнічення надмірної секреції андрогенів.
Подальше ведення пацієнта
Через вірилізуючий вплив материнських андрогенів на плід, при встановленому діагнозі надниркової гіперандрогенії, лікування дексаметазоном у початковій дозі 0,25 мг призначається до вагітності та продовжується в індивідуально підібраній дозі (від 0,5 до 1 мг) протягом усієї вагітності. У жінки зі звичним невиношуванням вагітності, яка страждає на надниркову гіперандрогенію, скасовувати лікування недоцільно, оскільки частота невиношування вагітності за відсутності лікування досягає 14%, за продовження - 9%.
Враховуючи той факт, що пацієнтки з адреногенітальним синдромом можуть передавати цей ген плоду, необхідно проводити пренатальну діагностику: на 17-18 тижні вагітності призначається аналіз крові для визначення вмісту 17-ОП у матері. Якщо рівень гормону в крові підвищений, визначається його концентрація в навколоплідних водах. Якщо вміст 17-ОП в навколоплідних водах підвищений, діагностується адреногенітальний синдром у плода. На жаль, визначити тяжкість адреногенітального синдрому (легка або важка форма з втратою солі) за рівнем 17-ОП в навколоплідних водах неможливо. Питання про збереження вагітності в цій ситуації вирішують батьки.
Якщо батько дитини є носієм гена адреногенітального синдрому і в родині були випадки народження дітей з цим синдромом, то пацієнтка, навіть без адренальної гіперандрогенії, отримує дексаметазон в інтересах плода (для запобігання вірилізації плода жіночої статі) у дозі 20 мкг/кг маси тіла, максимум 1,5 мг/добу у 2-3 прийоми після їди. На 17-18 тижні, після визначення статі плода та експресії гена адреногенітального синдрому (на основі результатів амніоцентезу), лікування продовжують до кінця вагітності, якщо плід – дівчинка з адреногенітальним синдромом. Якщо плід – хлопчик або дівчинка, яка не є носієм гена адреногенітального синдрому, прийом дексаметазону можна припинити.
Якщо жінка зі звичним невиношуванням вагітності страждає на гіперандрогенію надниркових залоз, то лікування дексаметазоном проводиться протягом усієї вагітності та припиняється лише після пологів. На 3-й день після пологів дозу дексаметазону поступово зменшують (на 0,125 мг кожні 3 дні) до повного припинення прийому препарату в післяпологовому періоді.
Гіперандрогенія змішаного генезу (яєчниково-надниркова)
Анамнез, результати фізикального огляду та спеціального обстеження
- В анамнезі: пізня менархе, порушення менструального циклу, такі як олігоменорея (зазвичай первинна, рідше вторинна), аменорея, можливі травми, струси мозку. Вагітності трапляються рідко, зазвичай спонтанно перериваються в першому триместрі, тривалі періоди безпліддя між вагітностями.
- Фізикальне обстеження: гірсутизм, акне, стрії, чорний акантоз, високий індекс маси тіла, гіпертензія.
- Графіки ректальної температури: ановуляторні цикли чергуються з циклами з овуляцією та НЛФ.
- Гормональне обстеження: високий рівень тестостерону, можуть бути підвищені рівні ФСГ та ЛГ, співвідношення ЛГ/ФСГ більше 3, високий рівень ДГЕАС, 17-ОП, може бути присутня гіперпролактинемія.
- УЗД: полікістоз яєчників.
- Електроенцефалографія: зміни біоелектричної активності мозку.
- Гіперінсулінемія, порушення ліпідного обміну (високий рівень холестерину, ліпопротеїнів низької та дуже низької щільності), знижена толерантність до глюкози або підвищений рівень глюкози в крові.
Лікування
Немедикаментозне лікування
Зниження ваги (низькокалорійна дієта, фізична активність).
Лікування медикаментами
Перший етап – за наявності інсулінорезистентності рекомендується призначати метформін у добовій дозі 1000-1500 мг для підвищення чутливості до інсуліну.
Другий етап – у разі тяжких порушень менструального циклу та високого рівня тестостерону рекомендується призначати препарати з антиандрогенною дією, що містять ципротерону ацетат (2 мг) та етинілестрадіол (35 мкг) протягом 3 місяців.
Третій етап – стимуляція овуляції з подальшою гестагенною підтримкою (схема описана вище) та прийомом дексаметазону в добовій дозі 0,25–0,5 мг.
У разі гіперпролактинемії та гіпотиреозу слід проводити відповідну корекцію препарату в циклах стимуляції овуляції. Якщо настає вагітність, прийом бромокриптину слід припинити, а прийом левотироксину продовжити.
Якщо стимуляція овуляції неефективна, слід вирішити питання про призначення прямих індукторів овуляції, доцільність хірургічного лікування полікістозних яєчників або екстракорпорального запліднення.
Подальше ведення пацієнта
У пацієнток з метаболічним синдромом вагітність часто ускладнюється артеріальною гіпертензією, нефропатією, гіперкоагуляцією, у зв'язку з чим необхідно контролювати артеріальний тиск, гемостазіограми з ранніх термінів вагітності та коригувати виниклі порушення (за необхідності) антигіпертензивними препаратами, антиагрегантами та антикоагулянтами. Гестагенні препарати призначають до 16 тижнів вагітності - дидрогестерон у дозі 20 мг/добу або мікронізований прогестерон у дозі 200 мг/добу в 2 прийоми.
Усі жінки з гіперандрогенією становлять групу ризику розвитку істміко-цервікальної недостатності. Спостереження за станом шийки матки слід проводити з 16-го тижня вагітності, за необхідності – хірургічна корекція істміко-цервікальної недостатності.
Імунологічні причини звичного невиношування вагітності
Наразі відомо, що близько 80% усіх раніше нез'ясованих випадків повторних втрат вагітності (після виключення генетичних, анатомічних, гормональних причин) пов'язані з імунними порушеннями. Розрізняють аутоімунні та алоімунні захворювання, що призводять до звичного невиношування вагітності.
При аутоімунних процесах власні тканини імунної системи стають об'єктом агресії, тобто імунна відповідь спрямована проти власних антигенів. У цій ситуації плід страждає вторинно в результаті пошкодження тканин матері.
При алоімунних захворюваннях імунна відповідь жінки спрямована проти ембріональних/фетальних антигенів, отриманих від батька та які потенційно є чужорідними для організму матері.
Аутоімунні захворювання, що найчастіше зустрічаються у пацієнток зі звичним невиношуванням вагітності, включають наявність антифосфоліпідних, антитиреоїдних та антинуклеарних аутоантитіл у сироватці крові. Так, встановлено, що у 31% жінок зі звичним невиношуванням поза вагітністю є аутоантитіла до тиреоглобуліну та тиреоїдної пероксидази (мікросомальні [тиреоїдної пероксидази] аутоантитіла); у цих випадках ризик спонтанного викидня в першому триместрі вагітності зростає до 20%. При звичному невиношуванні наявність антинуклеарних та антитиреоїдних антитіл вказує на необхідність подальшого обстеження для виявлення аутоімунного процесу та верифікації діагнозу.
Антифосфоліпідний синдром (АФС) залишається загальновизнаним аутоімунним захворюванням, що призводить до загибелі ембріона/плода.
Алоімунні розлади
Наразі до алоімунних процесів, що призводять до відторгнення плода, належать наявність підвищеної (більше 3) кількості спільних антигенів системи головного комплексу гістосумісності у подружжя (часто спостерігається у кровних шлюбах); низький рівень блокуючих факторів у сироватці крові матері; підвищений рівень природних кілерів (NK-клітин CD56, CD16) в ендометрії та периферичній крові матері як поза, так і під час вагітності; високий рівень концентрації низки цитокінів в ендометрії та сироватці крові, зокрема, γ-інтерферону, фактора некрозу пухлини а, інтерлейкінів-1 та 2.
Наразі вивчаються алоімунні фактори, що призводять до ранніх втрат вагітності, та способи корекції вищезазначених станів. Єдиної думки щодо методів терапії немає. На думку деяких дослідників, активна імунізація донорськими лімфоцитами не дає значного ефекту, тоді як інші автори описують значний позитивний ефект при такій імунізації та лікуванні імуноглобулінами.
Наразі одним з імуномодулюючих засобів на ранніх термінах вагітності є прогестерон. Зокрема, дослідження довели роль дидрогестерону в добовій дозі 20 мг у жінок зі звичним невиношуванням вагітності в першому триместрі вагітності з підвищеним рівнем клітин CD56 в ендометрії.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Генетично зумовлені тромбофілії
Наступні форми генетично зумовлених тромбофілій вважаються тромбофільними станами під час вагітності, що призводять до звичного невиношування вагітності.
- Дефіцит антитромбіну III.
- Мутація фактора V (Лейденська мутація).
- Дефіцит білка С.
- Дефіцит білка S.
- Мутація гена протромбіну G20210A.
- Гіпергомоцистеїнемія.
Обстеження для виявлення рідкісних причин тромбофілії необхідне у випадках, коли були:
- сімейний анамнез – тромбоемболія до 40 років у родичів;
- достовірні епізоди венозного та/або артеріального тромбозу до 40 років;
- рецидивуючий тромбоз у пацієнта та найближчих родичів;
- тромбоемболічні ускладнення під час вагітності та після пологів при використанні гормональної контрацепції;
- повторні втрати вагітності, мертвонародження, затримка внутрішньоутробного розвитку, відшарування плаценти;
- ранній початок прееклампсії, синдром HELLP.
Інфекційні причини звичного невиношування вагітності
Роль інфекційного фактора як причини звичного невиношування вагітності наразі є предметом широких дискусій. Відомо, що первинне інфікування на ранніх термінах вагітності може спричинити пошкодження ембріона, несумісне з життям, що призводить до спорадичних самовільних викиднів. Однак ймовірність реактивації інфекції одночасно з результатом повторних втрат вагітності є незначною. Крім того, мікроорганізми, що провокують звичне невиношування вагітності, наразі не виявлені. Дослідження останніх років показали, що у більшості жінок зі звичним невиношуванням вагітності та хронічним ендометритом в ендометрії переважають 2-3 або більше типів облігатних анаеробних мікроорганізмів та вірусів.
За даними В. М. Сідельникової та ін., у жінок, які страждають на звичне невиношування вагітності, діагноз хронічного ендометриту поза вагітністю був гістологічно верифікований у 73,1% випадків, а у 86,7% спостерігалася персистенція умовно-патогенних мікроорганізмів в ендометрії, що безумовно може бути причиною активації імунопатологічних процесів. Змішана персистуюча вірусна інфекція (вірус простого герпесу, Коксакі А, Коксакі В, ентеровіруси 68–71, цитомегаловірус) зустрічається у пацієнток зі звичним невиношуванням значно частіше, ніж у жінок з нормальним акушерським анамнезом. К. Когут та ін. (1997) показали, що відсоток запальних змін ендометрію та децидуальної тканини у пацієнток з первинним звичним невиношуванням значно вищий, ніж у жінок після невиношування вагітності з анамнезом хоча б одних доношених пологів.
Бактеріальна та вірусна колонізація ендометрію зазвичай є результатом нездатності імунної системи та неспецифічних захисних сил організму (системи комплементу, фагоцитозу) повністю ліквідувати інфекційний агент, і водночас його поширення обмежується активацією Т-лімфоцитів (Т-хелперів, природних кілерів) та макрофагів. У всіх вищезазначених випадках відбувається персистенція мікроорганізмів, що характеризується тяжінням до місця хронічного запалення мононуклеарних фагоцитів, природних кілерів, Т-хелперів, що синтезують різні цитокіни. Очевидно, такий стан ендометрію перешкоджає створенню локальної імуносупресії в передімплантаційному періоді, яка необхідна для формування захисного бар'єру та запобігання відторгненню напівчужого плода.
У зв'язку з цим, перед вагітністю жінкам зі звичним невиношуванням вагітності слід діагностувати хронічний ендометрит. Для встановлення або виключення цього діагнозу на 7-8-й день менструального циклу проводиться біопсія ендометрію з гістологічним дослідженням, ПЛР та бактеріологічним дослідженням матеріалу з порожнини матки. При верифікації діагнозу хронічний ендометрит лікують згідно зі стандартами лікування запальних захворювань органів малого тазу.

