Синтез, секреція та метаболізм катехоламінів
Останній перегляд: 19.10.2021

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Мозковий шар наднирників продукує з'єднання далекої від стероїдів структури. Вони містять 3,4-діоксіфенільное (катехоловое) ядро і називаються катехоламинами. До них відносяться адреналін, норадреналін і дофамін бета-оксітірамін.
Послідовність синтезу катехоламінів досить проста: тирозин → диоксифенилаланин (ДОФА) → дофамін → норадреналін → адреналін. Тирозин надходить в організм з їжею, але може і утворюватися з фенілаланіну в печінці під дією фенілаланінгідроксилази. Кінцеві продукти перетворення тирозину в тканинах різні. У мозковому шарі надниркових залоз процес протікає до стадії утворення адреналіну, в закінченнях симпатичних нервів - норадреналіну, в деяких нейронах центральної нервової системи синтез катехоламінів завершується утворенням дофаміну.
Перетворення тирозину в ДОФА каталізується тирозингідроксилази, кофакторами якої служать тетрагидро-біоптерин і кисень. Вважається, що саме цей фермент лімітує швидкість всього процесу біосинтезу катехоламінів і відзначено зниження кінцевими продуктами процесу. Тирозингідроксилази є головним об'єктом регуляторних впливів на біосинтез катехоламінів.
Перетворення ДОФА в дофамін каталізується ферментом ДОФА-декарбоксилази (кофактор - піридоксальфосфат), який щодо неспецифичен і декарбоксилируется і інші ароматичні L-амінокислоти. Однак є свідчення про можливість модифікації синтезу катехоламінів за рахунок зміни активності і цього ферменту. У деяких нейронах відсутні ферменти подальшого перетворення дофаміну, і саме він є кінцевим продуктом. Інші тканини містять дофамін-бета-гідроксилази (кофактор - мідь, аскорбінова кислота і кисень), яка перетворює дофамін в норадреналін. У мозковому шарі надниркових залоз (але не в закінченнях симпатичних нервів) присутній фенілетаноламін - метилтрансфераза, утворює з норадреналіну адреналін. Донором метальних груп в цьому випадку служить S-аденозилметионин.
Важливо пам'ятати, що синтез фенілетаноламін-N-Meтілтрансферази індукується глюкокортикоїдами, що потрапляють в мозковий шар з коркового по портальної венозної системи. У цьому, можливо, і криється пояснення факту об'єднання двох різних залоз внутрішньої секреції в одному органі. Значення глюкокортикоїдів для синтезу адреналіну підкреслюється тим, що клітини мозкового шару надниркових залоз, які продукують норадреналін, розташовуються навколо артеріальних судин, тоді як адреналінпродуцірующіе клітини отримують кров в основному з венозних синусів, локалізованих в кірковому шарі надниркових залоз.
Розпад катехоламінів протікає головним чином під впливом двох ферментних систем: катехол-О-метилтрансферази (КОМТ) і моноаміноксидази (МАО). Головні шляхи розпаду адреналіну і норадреналіну схематично представлені на рис. 54. Під дією КОМТ в присутності донора метилових груп S-адренозілметіоніна катехоламіни перетворюються в норметанефріна і метанефрин (3-О-метил-похідні норадреналіну і адреналіну), які під впливом МАО переходять в альдегіди і далі (в присутності альдегідоксидази) в ваніліл-мигдалеву кислоту (ВМК) - основний продукт розпаду норадреналіну і адреналіну. У тому ж випадку, коли катехоламіни спочатку піддаються дії МАО, а не КОМТ, вони перетворюються в 3,4-діоксіміндалевий альдегід, а потім під впливом альдегідоксидази і КОМТ - в 3,4-діоксіміндальную кислоту і ВМК. У присутності алкогольдегідрогенази з катехоламінів може утворюватися 3-метокси-4-оксіфенілгліколь, що є основним кінцевим продуктом деградації адреналіну і норадреналіну в ЦНС.
Розпад дофаміну протікає аналогічно, за тим винятком, що його метаболіти позбавлені гідроксильної групи у бета-вуглецевого атома, і тому замість ваніліл-мигдальної кислоти утворюється гомованіліновой (ГВК) або 3-метокси-4-оксіфенілуксусная кислота.
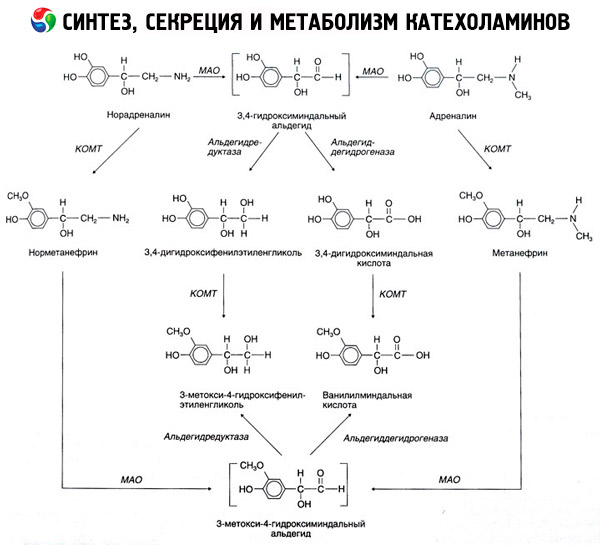
Постулюється також існування хіноїдному шляху окислення молекули катехоламінів, на якому можуть виникати проміжні продукти, що володіють вираженою біологічною активністю.
Утворені під дією цитозольних ферментів норадреналін і адреналін в закінченнях симпатичних нервів і мозковому шарі надниркових залоз надходять в секреторні гранули, що оберігає їх від дії ферментів деградації. Захоплення катехоламінів гранулами вимагає енергетичних витрат. У хромафинних гранулах мозкового шару надниркових залоз катехоламіни міцно пов'язані з АТФ (щодо 4: 1) і специфічними білками - хромогранина, що запобігає дифузії гормонів з гранул в цитоплазму.
Безпосереднім стимулом до секреції катехоламінів є, мабуть, проникнення в клітину кальцію, що стимулює екзоцитоз (злиття мембрани гранул з клітинної поверхнею і їх розрив з повним виходом розчинного вмісту - катехоламінів, дофамін-бета-гідроксилази, АТФ і хромогранина - в позаклітинне рідина) .
Фізіологічні ефекти катехоламінів і механізм їх дії
Дію катехоламінів починаються з взаємодії зі специфічними рецепторами клітин-«мішеней». Якщо рецептори тиреоїдних і стероїдних гормонів локалізуються всередині клітин, то рецептори катехоламінів (так само як і ацетилхоліну і пептидних гормонів) присутні на зовнішньої клітинної поверхні.
Вже давно було встановлено, що відносно одних реакцій адреналін або норадреналін виявляються більш ефективними, ніж синтетичний катехоламіни изопротеренол, тоді як щодо інших ефект изопротеренола перевершує дії адреналіну або норадреналіну. На цій підставі була розроблена концепція про наявність в тканинах двох типів адренорецепторів: альфа і бета, причому в окремих з них може бути присутнім тільки якийсь один з цих двох типів. Ізопротеренол є найбільш сильним агоністом бета-блокатори, тоді як синтетична сполука фенілефрін - найбільш сильним агоністом альфа-адреноблокатори. Природні катехоламіни - адреналін і норадреналін - здатні взаємодіяти з рецепторами обох типів, однак адреналін виявляє більшу спорідненість до бета-, а норадреналін - до альфа-рецепторів.
Катехоламіни сильніше активують серцеві бета-адренорецептори, ніж бета-рецептори гладких м'язів, що дозволило поділити бета-тип на підтипи: бета 1 рецептори (серце, жирові клітини) і бета 2 рецептори (бронхи, кровоносні судини і т. Д.). Дія изопротеренола на бета1-рецептори перевершує дію адреналіну і норадреналіну лише в 10 разів, тоді як на бета2-рецептори він діє в 100-1000 разів сильніше, ніж природні катехоламіни.
Застосування специфічних антагоністів (фентоламін і феноксибензаміном щодо альфа- і пропранололу щодо бета-рецепторів) підтвердило адекватність класифікації адренорецепторів. Дофамін здатний взаємодіяти як з альфа-, так і з бета-рецепторами, але в різних тканинах (мозок, гіпофіз, судини) знайдені і власні дофаминергические рецептори, специфічним блокатором яких є галоперидол. Кількість бета-рецепторів коливається від 1000 до 2000 на клітку. Біологічні ефекти катехоламінів, опосередковувані бета-рецепторами, пов'язані, як правило, з активацією аденілатциклази і підвищенням внутрішньоклітинного вмісту цАМФ. Рецептор і фермент хоча і з'єднані функціонально, але являють собою різні макромолекули. В модуляції аденілатціклазной активності під впливом гормон-рецепторного комплексу беруть участь гуанозинтрифосфат (ГТФ) і інші пуринові нуклеотиди. Підвищуючи активність ферменту, вони, мабуть, знижують спорідненість бета-рецепторів до агонистам.
Давно відомий феномен підвищення чутливості денервірованних структур. Навпаки, тривалий вплив агоністів знижує чутливість тканин-«мішеней». Вивчення бета-рецепторів дозволило пояснити ці явища. Показано, що тривалий вплив изопротеренола призводить до втрати чутливості аденілатциклази за рахунок зменшення числа бета-рецепторів.
Процес десенситизации не вимагає активації синтезу білка і обумовлений, ймовірно, поступовим утворенням необоротних гормон-рецепторних комплексів. Навпаки, введення 6-оксідофаміна, що руйнує симпатичні закінчення, супроводжується збільшенням числа реагують бета-рецепторів в тканинах. Не виключено, що підвищення симпатичної нервової активності обумовлює і вікову десенситизацию судин і жирової тканини по відношенню до катехоламінів.
Число блокатори в різних органах може контролюватися і іншими гормонами. Так, естрадіол збільшує, а прогестерон зменшує число альфа-адреноблокатори в матці, що супроводжується відповідним підвищенням і зниженням її скорочувальної реакції на катехоламіни. Якщо внутрішньоклітинним «другим месенджером», що утворюється при дії агоністів бета-рецепторів, напевно є цАМФ, то відносно передавача альфа-адренергічних впливів справа йде складніше. Передбачається існування різних механізмів: зниження рівня цАМФ, підвищення вмісту цАМФ, модуляція клітинної динаміки кальцію і ін.
Для відтворення різноманітних ефектів в організмі зазвичай потрібні дози адреналіну, в 5-10 разів менші, ніж норадреналіну. Хоча останній є більш ефективним щодо а- і бета1-адреноблокатори, важливо пам'ятати, що обидва ендогенних катехоламіну здатні взаємодіяти як з альфа-, так і з бета-рецепторами. Тому біологічна реакція даного органу на адренергічну активацію багато в чому залежить від типу присутніх в ньому рецепторів. Однак це не означає, що виборча активація нервового або гуморального ланки симпатоадреналової системи неможлива. У більшості випадків спостерігається посилена діяльність різних її ланок. Так, прийнято вважати, що гіпоглікемія рефлекторно активує саме мозковий шар надниркових залоз, тоді як зниження артеріального тиску (постуральна гіпотензія) супроводжується в основному викидом норадреналіну з закінчень симпатичних нервів.
Адренорецептори і ефекти їх активації в різних тканинах
|
Система, орган |
Тип адрено-рецепторів |
Реакція |
|
Серцево-судинна система: |
||
|
Серце |
Бета |
Підвищення частоти скорочень, провідності і скоротливості |
|
Артеріоли: |
||
|
Шкіри і слизових оболонок |
Альфа |
Скорочення |
|
Скелетних м'язів |
Бета |
Розширення Скорочення |
|
Органів черевної порожнини |
Альфа (більше) |
Скорочення |
|
Бета |
Розширення |
|
|
Відня |
Альфа |
Скорочення |
|
Дихальна система: |
||
|
М'язи бронхів |
Бета |
Розширення |
|
Травна система: |
||
|
Шлунок |
Бета |
Зниження моторики |
|
Кишечник |
Альфа |
Скорочення сфінктерів |
|
Селезінка |
Альфа |
Скорочення |
|
Бета |
Розслаблення |
|
|
Зовнішньосекреторна частина підшлункової залози |
Альфа |
Зниження секреції |
|
Сечостатева система: |
Альфа |
Скорочення сфінктера |
|
Сечовий міхур |
Бета |
Розслаблення виганяє м'язи |
|
Чоловічі статеві органи |
Альфа |
Еякуляція |
|
Очі |
Альфа |
Розширення зіниці |
|
Шкіра |
Альфа |
Підвищення потовиділення |
|
Слинні залози |
Альфа |
Виділення калію і води |
|
Бета |
Секреція амілази |
|
|
Ендокринні залози: |
||
|
Острівці підшлункової залози |
||
|
Бета-клітини |
Альфа (більше) |
Зниження секреції інсуліну |
|
Бета |
Підвищення секреції інсуліну |
|
|
Альфа-клітини |
Бета |
Підвищення секреції глюкагону |
|
8-клітини |
Бета |
Підвищення секреції соматостатину |
|
Гіпоталамус і гіпофіз: |
||
|
Соматотрофи |
Альфа |
Підвищення секреції СТГ |
|
Бета |
Зниження секреції СТГ |
|
|
Лактотрофи |
Альфа |
Зниження секреції пролактину |
|
Тіреотрофов |
Альфа |
Зниження секреції ТТГ |
|
Кортікотрофи |
Альфа |
Підвищення секреції АКТГ |
| бета | Зниження секреції АКТГ | |
|
Щитовидна залоза: |
||
|
Фолікулярні клітини |
Альфа |
Зниження секреції тироксину |
|
Бета |
Підвищення секреції тироксину |
|
|
Парафоллікулярние (К) клітини |
Бета |
Підвищення секреції кальцитоніну |
|
Околощітовідние залози |
Бета |
Підвищення секреції ПТГ |
|
Нирки |
Бета |
Підвищення секреції реніну |
|
Шлунок |
Бета |
Підвищення секреції гастрину |
|
Основний обмін |
Бета |
Підвищення споживання кисню |
|
Печінка |
? |
Підвищення гликогенолиза і глюконеогенезу з виходш глюкози; підвищення кетогенеза з виходом кетонових тіл |
|
Жирова тканина |
Бета |
Підвищення ліполізу з виходом вільних жирних кислот і гліцерину |
|
Скелетні м'язи |
Бета |
Підвищення гліколізу з виходом пірувату і лактату; зниження протеолізу зі зменшенням виходу аланина, глутаміну |
Важливо враховувати, що результати внутрішньовенного введення катехоламінів не завжди адекватно відображають ефекти ендогенних з'єднань. Це відноситься в основному до норадреналіну, так як в організмі він виділяється головним чином не в кров, а безпосередньо в синаптичні щілини. Тому ендогенний норадреналін активує, наприклад, не тільки судинні альфа-рецептори (підвищення артеріального тиску), але і бета-рецептори серця (почастішання серцебиття), тоді як введення норадреналіну ззовні призводить переважно до активації судинних альфа-рецепторів і рефлекторному (через вагус) уповільнення серцебиття.
Низькі дози адреналіну активують в основному бета-рецептори м'язових судин і серця, в результаті чого падає периферичний судинний опір і збільшується хвилинний обсяг серця. У деяких випадках перший ефект може переважати, і після введення адреналіну розвивається гіпотензія. У більш високих дозах адреналін активує і альфа-рецептори, що супроводжується підвищенням периферичного судинного опору і на тлі зростання хвилинного обсягу серця призводить до підвищення артеріального тиску. Однак зберігається і його вплив на судинні бета-рецептори. В результаті приріст систолічного тиску перевищує аналогічний показник діастолічного (збільшення пульсового тиску). При введенні ще більших доз починають переважати альфа-миметические ефекти адреналіну: систолічний та діастолічний тиск зростають паралельно, як під впливом норадреналіну.
Вплив катехоламінів на обмін речовин складається з їх прямих і опосередкованих ефектів. Перші реалізуються головним чином через бета-рецептори. Більш складні процеси пов'язані з печінкою. Хоча посилення печінкового глікогенолізу традиційно вважається результатом активації бета-рецепторів, але є дані і про участь в цьому альфа-рецепторів. Опосередковані ефекти катехоламінів пов'язані з модуляцією секреції багатьох інших гормонів, наприклад інсуліну. У дії адреналіну на його секрецію явно переважає альфа-адренергічні компонент, оскільки показано, що будь-який стрес супроводжується гальмуванням інсулінової секреції.
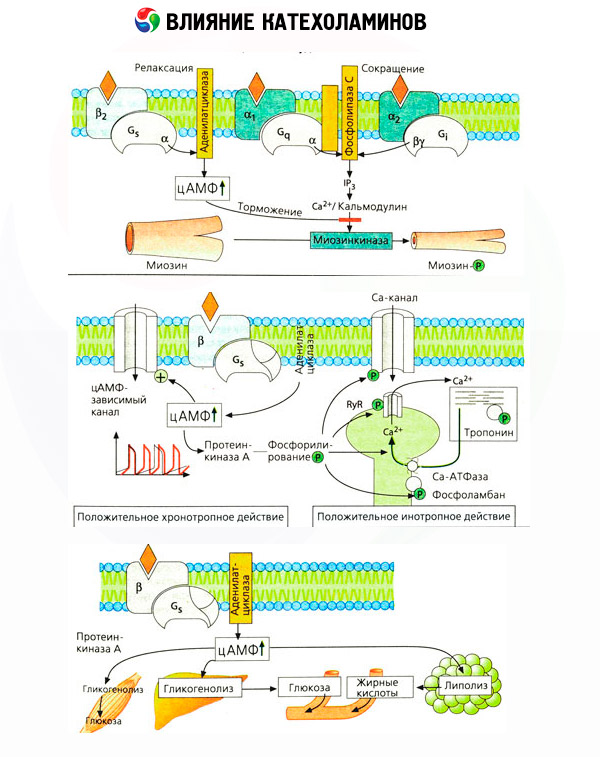
Поєднання прямих і опосередкованих ефектів катехоламінів обумовлює гіперглікемію, пов'язану не тільки з підвищенням печінкової продукції глюкози, але і з гальмуванням її утилізації периферійними тканинами. Прискорення ліполізу викликає гіперліпацідеміі з підвищеною доставкою жирних кислот в печінку і інтенсифікацією продукції кетонових тел. Посилення гліколізу в м'язах призводить до підвищення виходу в кров лактату і пірувату, які разом з гліцерином, що вивільняються з жирової тканини, служать попередниками печінкового глюконеогенезу.
Регуляція секреції катехоламінів. Подібність продуктів і способів реагування симпатичної нервової системи і мозкового шару надниркових залоз стало підставою для об'єднання цих структур в єдину симпатико-адреналової систему організму з виділенням нервового і гормонального її ланки. Різні аферентні сигнали концентруються в гіпоталамусі та центрах спинного і довгастого мозку, звідки виходять еферентні посилки, перемикаються на клітинні тіла прегангліонарних нейронів, розташованих в бічних рогах спинного мозку на рівні VIII шийного - II-III поперекових сегментів.
Прегангліонарних аксони цих клітин залишають спинний мозок і утворюють синаптичні з'єднання з нейронами, що локалізуються в гангліях симпатичної ланцюжка, або з клітинами мозкового шару надниркових залоз. Ці прегангліонарних волокна є холинергическими. Перша принципова відмінність симпатичних постгангліонарних нейронів і хромафинних клітин мозкового шару надниркових залоз полягає в тому, що останні передають що надходить до них холинергический сигнал НЕ нервово-провідникові (постгангліонарні адренергічні нерви), а гуморальним шляхом, виділяючи адренергические з'єднання в кров. Друга відмінність зводиться до того, що постгангліонарні нерви продукують норадреналін, тоді як клітини мозкового шару надниркових залоз - переважно адреналін. Ці дві речовини надають різну дію на тканини.

