Нейролептики, або антипсихотики
Останній перегляд: 24.06.2018

Ми маємо суворі правила щодо джерел інформації та посилаємося лише на авторитетні медичні сайти, академічні дослідницькі установи та, по можливості, на медично рецензовані дослідження. Зверніть увагу, що числа в дужках ([1], [2] тощо) є клікабельними посиланнями на ці дослідження.
Якщо ви вважаєте, що будь-який з наших матеріалів є неточним, застарілим або іншим чином сумнівним, будь ласка, виберіть його та натисніть Ctrl + Enter.
Антипсихотики (нейролептики) – це клас психотропних препаратів, що переважно використовуються для лікування шизофренії. Наразі прийнято розрізняти дві групи (або категорії) препаратів: типові та атипові антипсихотики. Нижче наведено інформацію про фармакологічні властивості, показання до застосування та побічні ефекти терапії для кожної з цих груп препаратів.
Показання до застосування типових антипсихотичних препаратів
Наразі до основних показань до призначення традиційних нейролептиків, згідно з рекомендаціями авторитетних дослідників у галузі психофармакотерапії, належать наступні.
- Полегшення психомоторного збудження та поведінкових розладів, спричинених тяжкими психотичними симптомами. У цих випадках показано застосування пероральних або парентеральних форм препаратів з антипсихотичною дією, як глобальної (клопромазин, левомепромазин, тіопроперазин, зуклопентиксол), так і селективної – у вигляді впливу на галюцинаторно-параноїдні розлади (галоперидол, трифлуоперазин).
- Протирецидивна (профілактична) терапія. З цією метою призначають депо-форми препаратів, особливо пацієнтам з поганою комплаєнсністю до ліків (галоперидолу деканоат, пролонгована форма флупентиксолу), або малі чи середні дози препаратів для отримання дезінгібіторного (антинегативного) ефекту, з числа тих препаратів, високі дози яких використовуються для купірування гострих психотичних розладів (флупентиксол, зуклопентиксол). У цьому виді терапії також рекомендується призначати так звані малі нейролептики (тіоридазин, хлорпротиксен, сульпірид), психотропна активність яких полягає у впливі на прояви депресивного полюса та безсонні розлади.
- Подолання терапевтичної резистентності до атипових антипсихотиків при лікуванні гострих психотичних станів. Для цього зазвичай використовуються парентеральні форми традиційних антипсихотиків з глобальною (хлорпромазин, левомепромазин тощо) та селективною (галоперидол) антипсихотичною дією.
Ці препарати викликають різні побічні ефекти, характер яких залежить від особливостей фармакологічного профілю кожного препарату. Антипсихотики з більш вираженим холінолітичним ефектом частіше викликають порушення акомодації, запор, сухість у роті та затримку сечі. Седативний ефект більш характерний для антипсихотиків з вираженим антигістамінним ефектом, а ортостатична гіпотензія – для препаратів, що блокують α1-адренорецептори. Блокада холінергічної, нордренергічної та дофамінергічної передачі типовими нейролептиками може призвести до низки розладів у статевій сфері, таких як аменорея або дисменорея, аноргазмія, галакторея, набряк та болючість молочних залоз, зниження потенції. Побічні ефекти в статевій сфері в основному пов'язані з холінолітичними та адреноблокуючими властивостями цих препаратів, а також зі збільшенням секреції пролактину внаслідок блокади метаболізму дофаміну. Найсерйознішими побічними ефектами типових нейролептиків є рухові порушення. Вони є найчастішою причиною припинення прийому ліків пацієнтами. Три основні побічні ефекти терапії, пов'язані з впливом на рухову сферу, включають ранні екстрапірамідні синдроми, тардивну дискінезію та ЗНС.
Вважається, що екстрапірамідні синдроми пов'язані з блокадою D2-рецепторів у базальних гангліях. До них належать дистонія, нейролептичний паркінсонізм та акатизія. Прояви гострої дистонічної реакції (ранньої дискінезії) включають раптово розвивається гіперкінез, окулогірні кризи, скорочення м'язів обличчя та тулуба, опістотонус. Ці розлади залежать від дози та часто виникають через 2-5 днів терапії високопотужними нейролептиками, такими як галоперидол та флуфеназин. Для полегшення ранньої дискінезії дозу нейролептика зменшують та призначають антихолінергічні препарати (біпериден, тригексифенидил). Тардивна дискінезія зазвичай уражає м'язи шиї та, на відміну від гострої дистонічної реакції, менш чутлива до лікування антихолінергічними препаратами. Нейролептичний паркінсонізм характеризується зниженням спонтанної моторики, гіпо- та амімією, тремором спокою та ригідністю. Важливо відрізняти ці симптоми від зовні схожих негативних розладів при шизофренії, які представлені емоційною відчуженістю, притупленням афекту та анергією. Для корекції цих побічних ефектів показано застосування антихолінергічних препаратів, зменшення дози нейролептика або його заміна атиповим антипсихотиком. Акатизія проявляється внутрішньою тривогою, неможливістю тривалий час залишатися на одному місці та необхідністю постійно рухати руками або ногами. Для її полегшення застосовують антихолінергічні препарати та центральні бета-адреноблокатори (пропранолол).
Пізня дискінезія проявляється мимовільними рухами будь-якої групи м'язів, найчастіше м'язів язика та рота. Клінічно виділяють ряд її форм: дискінезія м'язів щік, язика, рота (періодичні скорочення жувальних м'язів, що створюють враження гримасуючої особи, язик може мимоволі висуватися з рота пацієнта); пізня дистонія та пізня акатизія; (хворий здійснює хореоатетоїдні рухи головою, тулубом, верхніми та нижніми кінцівками). Ця форма порушення реєструється переважно при тривалому лікуванні традиційними нейролептиками та виявляється приблизно у 15-20% пацієнтів, які приймають їх як підтримуючу терапію. Ймовірно, у деяких пацієнтів ризик розвитку симптомів дискінезії підвищений, оскільки деякі з них спостерігалися в клініці шизофренії ще до «нейролептичної ери». Крім того, пізня дискінезія описана у літніх жінок та пацієнтів з афективними розладами. Вважається, що тардивна дискінезія пов'язана зі збільшенням кількості дофамінових рецепторів у стріатумі, хоча ГАМКергічна та інші нейромедіаторні системи також ймовірно беруть участь у її патогенезі. Ефективного універсального лікування таких побічних ефектів не існує. Вважається, що низькі дози високопотенційних нейролептиків з блокуючою дією дофаміну або вітаміну Е можуть мати помірний позитивний ефект при цих розладах. Найефективнішим заходом при тардивній дискінезії є зниження дози типового нейролептика або його заміна атиповим антипсихотиком.
Згідно з сучасними даними, злоякісний нейролептичний синдром зустрічається приблизно в 0,5% випадків психофармакотерапії. Ймовірно, рідкісну виникнення такого небезпечного для життя ускладнення наразі можна пояснити широким впровадженням у практику атипових антипсихотиків, оскільки ризик розвитку ЗНС під час лікування цими препаратами є незначним. Загальновизнано, що основною причиною розвитку ЗНС є надмірна блокада дофамінергічної системи під час терапії нейролептиками, особливо після збільшення дози високопотужного антипсихотика. Основними симптомами ЗНС є гіпертермія, підвищення тонусу скелетних м'язів та сухожильних рефлексів, порушення свідомості з переходом у кому. Аналізи крові виявляють лейкоцитоз, збільшення швидкості осідання еритроцитів, активності печінкових трансаміназ; аналізи сечі виявляють наявність альбумінурії. Порушення водно-електролітного балансу виникають швидко, що створює передумови для формування набряку мозку. ЗНС – це гострий стан, що вимагає термінової госпіталізації пацієнта для інтенсивної інфузійної терапії. У лікуванні ЗНС найважливіше значення мають гідратація та симптоматична терапія. У цій ситуації будь-які призначені нейролептики потребують негайного припинення прийому. У деяких випадках позитивний ефект мають агоністи дофамінових рецепторів (наприклад, бромокриптин) або міорелаксанти, хоча їх ефективність не вивчалася. Після усунення ЗНС прийом нейролептика не слід відновлювати протягом щонайменше двох тижнів. Згодом може бути призначений низькопотенційний антипсихотик, бажано препарат нового покоління. Дозу щойно призначеного препарату слід збільшувати вкрай обережно, контролюючи стан життєво важливих функцій та лабораторні дані (аналізи крові та сечі).
Типові нейролептики рідко викликають небезпечні смертельні ускладнення. Прояви передозування в основному пов'язані з індивідуальним профілем антиадренергічної та антихолінергічної дії препарату. Оскільки ці препарати мають сильну протиблювотну дію, для їх виведення з організму показано промивання шлунка, а не призначення блювотних засобів. Артеріальна гіпотензія, як правило, є наслідком блокади адренергічних рецепторів, і її слід коригувати введенням дофаміну та норадреналіну. У разі серцевої аритмії показано застосування лідокаїну.
Механізм дії та фармакологічні ефекти типових антипсихотиків
У міру розвитку психофармакології пропонувалися різні варіанти впливу антипсихотичних препаратів на нейрорецептори. Основною залишається гіпотеза про їхній вплив на дофамінові нейроструктури (перш за все, D2-рецептори), що ґрунтується на даних про порушення нормального метаболізму дофаміну в структурах мозку при психозах. Дофамінові D2-рецептори розташовані в базальних гангліях, прилеглому ядрі та лобовій корі; вони відіграють провідну роль у регуляції потоку інформації між корою головного мозку та таламусом.
На рисунку показано детальніше розуміння порушень передачі дофаміну в коркових та підкіркових ділянках мозку та ролі цих порушень у розвитку симптомів шизофренії (адаптовано з монографії Джонса Р.Б., Баклі П.Ф., 2006).
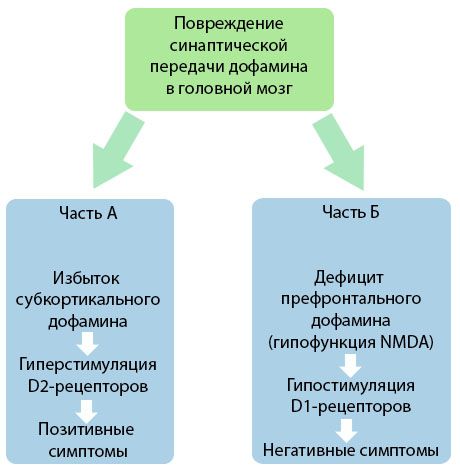
Частина А відображає класичну, ранню дофамінову теорію, постулюючи надлишок дофаміну в підкіркових ділянках та гіперстимуляцію D2-рецепторів, що призводить до виникнення продуктивних симптомів. Частина B демонструє подальшу модернізацію теорії на початку 1990-х років. Дані, отримані до цього часу, показали, що дефіцит дофаміну в D-рецепторах, разом з недостатньою стимуляцією цих рецепторів у префронтальній корі, призводить до виникнення негативних симптомів та когнітивних дефіцитів. Тому, згідно з сучасним розумінням, обидва типи порушень дофамінергічної передачі - надлишок підкіркового дофаміну та його дефіцит у префронтальній корі - є комбінованим результатом порушення синаптичної передачі в префронтальній ділянці та пов'язані з гіпофункцією N-метил-N-аспартату. Окрім спочатку виділеного дофаміну, пізніше були ідентифіковані інші нейромедіатори, що беруть участь у патогенезі шизофренії, такі як серотонін, гамма-аміномасляна кислота, глутамат, норадреналін, ацетилхолін та різні нейропептиди. Хоча роль цих медіаторів до кінця не вивчена, тим не менш, у міру розвитку знань стає зрозуміло, що прояв численних нейрохімічних зрушень в організмі. Отже, клінічний ефект антипсихотичного препарату є сумацією впливу на різні рецепторні утворення та призводить до усунення порушень гомеостазу.
В останні роки, завдяки появі нових методів дослідження, таких як зв'язування радіоізотопних лігандів та ПЕТ-сканування, досягнуто значного прогресу у з'ясуванні тонкого біохімічного механізму дії нейролептиків. Зокрема, визначено порівняльну силу та тропізм препаратів до зв'язування з окремими нейрорецепторами в різних ділянках та структурах мозку. Показано пряму залежність тяжкості антипсихотичного ефекту препарату від сили його блокуючого впливу на різні дофамінергічні рецептори. Нещодавно було виявлено чотири типи таких рецепторів:
- D1 розташовані переважно в області чорної субстанції та стріатуму (так звана нігростріатальна область), а також префронтальної області;
- D2 – у нігростріатальній, мезолімбічній ділянках та передній долі гіпофіза (секреція пролактину);
- D3 (пресинаптичні) – у різних структурах мозку контролюють дофамінергічну активність за законом негативного зворотного зв'язку;
- D4 (пресинаптичний) – переважно в нігростріатальній та мезолімбічній ділянках.
Водночас, зараз можна вважати доведеним, що саме блокада D2-рецепторів спричиняє розвиток антипсихотичних, вторинних седативних ефектів, а також екстрапірамідних побічних ефектів. Іншими клінічними проявами блокади цього типу рецепторів є знеболювальний та протиблювотний ефект нейролептиків (зменшення нудоти, блювання в результаті пригнічення блювотного центру), а також зниження вмісту гормону росту та збільшення вироблення пролактину (нейроендокринні побічні ефекти, включаючи галакторею та порушення менструального циклу). Тривала блокада нігростріатальних D2-рецепторів призводить до появи їх гіперчутливості, що відповідає за розвиток пізньої дискінезії та «гіперчутливих психозів». Ймовірні клінічні прояви блокади пресинаптичних D3- та D4-рецепторів пов'язані переважно зі стимулюючим ефектом нейролептиків. Через часткову блокаду цих рецепторів у нігростріатальній та мезолімбокортексній ділянках, активуючі та інцизивні (потужні, високоактивні) нейролептики у малих дозах можуть стимулювати, а у високих – пригнічувати дофамінергічну передачу.
В останні роки різко зріс інтерес до функції серотонінергічних систем мозку, включаючи серотонінергічні рецептори. Річ у тім, що в різних частинах мозку серотонінергічна система має модулюючий вплив на дофамінергічні структури. Зокрема, в мезокортикальній області серотонін пригнічує вивільнення дофаміну, і відповідно, блокада постсинаптичних 5-HT рецепторів призводить до збільшення вмісту дофаміну. Як відомо, розвиток негативної симптоматики при шизофренії пов'язаний з гіпофункцією дофамінових нейронів у префронтальних структурах кори головного мозку. Наразі відомо близько 15 типів центральних 5-HT рецепторів. Експериментально виявлено, що нейролептики зв'язуються переважно з 5-HT рецепторами перших трьох типів.
Ці препарати мають переважно стимулюючий (агоністичний) вплив на 5-HT1a рецептори. Ймовірні клінічні наслідки: підвищення антипсихотичної активності, зменшення тяжкості когнітивних розладів, корекція негативних симптомів, антидепресивний ефект та зниження частоти екстрапірамідних побічних ефектів.
Вплив нейролептиків на 5-HT2-рецептори, особливо на підтипи 5-HT2a, має значне значення. Вони розташовані переважно в корі головного мозку, і їх чутливість підвищена у пацієнтів із шизофренією. Здатність нейролептиків нового покоління зменшувати вираженість негативних симптомів, покращувати когнітивні функції, регулювати сон шляхом збільшення загальної тривалості повільнохвильових (D-хвильових) стадій сну, зменшувати агресію та полегшувати депресивні симптоми та мігренеподібні (що виникають внаслідок цереброваскулярних розладів) головні болі пов'язана з блокадою 5-HT2a-рецепторів. З іншого боку, при блокаді 5-HT2a-рецепторів можливі гіпотензивні ефекти та порушення еякуляції у чоловіків.
Вважається, що вплив нейролептиків на 5-HT2c-рецептори викликає седативний (анксіолітичний) ефект, підвищення апетиту (що супроводжується збільшенням маси тіла) та зниження вироблення пролактину.
5-HT3-рецептори розташовані переважно в лімбічній ділянці, і при їх блокуванні спочатку розвивається протиблювотний ефект, а також посилюються антипсихотичний та анксіолітичний ефекти.
Виникнення симптомів, подібних до паркінсонізму, також залежить від блокуючої здатності препарату щодо мускаринових холінергічних рецепторів. Холінолітичний та дофамінблокуючий ефекти певною мірою знаходяться у реципрокних зв'язках. Відомо, наприклад, що в нігростріатальній ділянці D2-рецептори пригнічують вивільнення ацетилхоліну. Коли блокується понад 75% D2-рецепторів у нігростріатальній ділянці, баланс порушується на користь холінергічної системи. Це є причиною коригувальної дії антихолінергічних препаратів (коректорів) на екстрапірамідні побічні ефекти нейролептиків. Хлорпротиксен, клозапін та оланзапін мають високу спорідненість до мускаринових рецепторів і практично не викликають екстрапірамідних побічних ефектів, оскільки блокують холінергічні та дофамінергічні рецептори одночасно. Галоперидол та піперазинові фенотіазинові похідні мають виражений вплив на дофамінові рецептори, але дуже слабкий вплив на холінові рецептори. Це пов'язано з їхньою здатністю викликати виражені екстрапірамідні побічні ефекти, які зменшуються при застосуванні дуже високих доз, коли стає помітним холінолітичний ефект. Окрім зниження блокуючого дофамін ефекту на D2-рецептори нігростріатальної області та нівелювання екстрапірамідних побічних ефектів, сильний холінергічний ефект може спричинити погіршення когнітивних функцій, включаючи розлади пам'яті, а також периферичні побічні ефекти (сухість слизових оболонок, порушення зорової акомодації, запор, затримку сечі, сплутаність свідомості тощо). Нейролептики мають досить сильну блокуючу дію на гістамінові рецептори I типу, що пов'язано, перш за все, з вираженістю седативного ефекту, а також збільшенням маси тіла через підвищений апетит. Протиалергічна та протисвербіжна дія нейролептиків також пов'язана з їх антигістамінними властивостями.
Окрім блокування дофаміну, антисеротонінергічної, холінолітичної та антигістамінної дії, більшість нейролептиків мають адренолітичні властивості, тобто блокують як центральні, так і периферичні α1-адренорецептори. Адреноблокатори, такі як хлорпромазин та хлорпротиксен, мають виражену седативну дію. Крім того, блокуюча дія цих препаратів може спричиняти нейровегетативні побічні ефекти (артеріальну гіпотензію, тахікардію тощо), а також посилення гіпотензивної дії адреноблокаторів.
У роботах великої кількості авторів наведено дані про силу зв'язування (афінність) окремих нейролептиків з різними типами нейрорецепторів.
Виходячи з їхнього нейрохімічного профілю дії, типові та атипові антипсихотики, серед тих, що переважно використовуються в клінічній практиці, умовно можна розділити на шість груп.
Першу групу складають селективні блокатори D2- та D4-рецепторів (сульпірид, амісудприд, галоперидол тощо) з груп похідних бензаміду та бутирофенону. У малих дозах, переважно завдяки блокаді пресинаптичних D4-рецепторів, вони активують дофамінергічну передачу нервових імпульсів та мають стимулюючий (дезінгібіторний) ефект, у великих дозах блокують D2-рецептори у всіх ділянках мозку, що клінічно проявляється вираженим антипсихотичним ефектом, а також екстрапірамідними та ендокринними (обумовленими пролактинемією) побічними ефектами.
До другої групи належать високоактивні блокатори D2-рецепторів, а також препарати, що слабко або помірно блокують 5-HT2a- та 5-HT1a-рецептори (флупентиксол, флуфеназин, зуклопентиксол тощо), тобто переважно піперазинові похідні фенотіазину або тіоксантени, близькі до них за стереохімічною структурою. Як і препарати першої групи, ці нейролептики мають, перш за все, виражену антипсихотичну (антипсихотичну) дію, а також викликають екстрапірамідні ефекти та пролактинемію. У малих дозах вони мають помірно активуючу (психостимулюючу) дію.
Третю групу складають полівалентні седативні нейролептики, які недиференційовано блокують більшість нейрорецепторів. Ці препарати мають чітко виражену блокуючу дію на дофамінові рецептори, а також викликають сильний адренолітичний та холінолітичний ефекти. Сюди входить більшість седативних нейролептиків, насамперед аліфатичні та піперидинові похідні фенотіазину, а також тіоксантени, близькі до них за стереохімічною структурою (хлорпромазин, левомепромазин, хлорпротиксен тощо). У спектрі психотропної активності цих препаратів домінує, перш за все, виражений первинний седативний ефект, що розвивається незалежно від застосовуваної дози, та помірний антипсихотичний ефект. Крім того, завдяки вираженому антихолінергічному ефекту, препарати цієї групи викликають слабкі або помірні екстрапірамідні та нейроендокринні побічні ефекти, але часто призводять до розвитку ортостатичної гіпотензії та інших вегетативних реакцій через виражену блокаду a1-адренорецепторів.
До четвертої групи належать нейролептики, що блокують D2- та 5-HT2a-рецептори збалансовано, тобто в однаковій мірі (останні дещо більшою мірою) та a1-адренорецептори в помірній мірі. До цієї групи належать представники нового покоління атипових антипсихотиків (рисперидон, зипразидон, сертиндол), які мають різні хімічні структури. Нейрохімічний механізм дії визначає їхній селективний вплив насамперед на мезолімбічні та мезокортикальні ділянки мозку. Поряд з виразним антипсихотичним ефектом, відсутністю або слабкою вираженістю екстрапірамідних побічних ефектів (при використанні терапевтичних доз), слабкою або помірною пролактинемією та помірними адренолітичними властивостями (гіпотензивні реакції), ця група нейролептиків здатна коригувати негативні симптоми шляхом непрямої стимуляції дофамінергічної передачі в корі головного мозку.
П'яту групу складають полівалентні атипові антипсихотики трициклічного дибензодіазепіну або подібної за структурою (клозапін, оланзапін та кветіапін). Як і препарати третьої групи, вони блокують більшість нейрорецепторів недиференційовано. Однак 5-HT2a-рецептори блокуються сильніше, ніж D2- та D4-рецептори, особливо ті, що розташовані в нігростріатальній ділянці. Це визначає фактичну відсутність або слабку екстрапірамідну дію та відсутність нейроендокринних побічних ефектів, пов'язаних зі збільшенням вироблення пролактину з виразним антипсихотичним ефектом та здатністю зменшувати тяжкість негативних симптомів. Крім того, всі препарати цієї групи мають виражені адренолітичні та антигістамінні властивості, що визначає седативний та гіпотензивний ефекти. Клозапін та оланзапін також мають досить виражену блокуючу дію на мускаринові рецептори та призводять до розвитку холінолітичних побічних ефектів.
Таким чином, здатність блокувати постсинаптичні дофамінергічні рецептори з компенсаторним збільшенням синтезу та метаболізму дофаміну є єдиною спільною біохімічною властивістю для всіх нейролептиків, що розглядаються в цих групах.
До шостої групи належить єдиний атиповий антипсихотик – арипіпразол, який з'явився на вітчизняному психофармакологічному ринку відносно недавно. Цей препарат є частковим агоністом D2-дофамінових рецепторів, і діє як функціональний антагоніст у гіпердопамінергічному стані та як функціональний агоніст у гіподопамінергічному профілі. Такий унікальний рецепторний профіль арипіпразолу дозволяє знизити ризик екстрапірамідних розладів та гіперпролактинемії при його застосуванні. Крім того, арипіпразол діє як частковий агоніст 5-HT1a рецепторів і водночас є антагоністом 5-HT2a рецепторів. Передбачається, що така взаємодія з рецепторами призводить до загалом збалансованого функціонування серотонінової та дофамінової систем, тому механізм дії арипіпразолу можна позначити як стабілізацію дофамін-серотонінової системи.
Таким чином, сучасний рівень знань про нейрохімічні механізми дії нейролептиків дозволяє запропонувати нову, патогенетично більш обґрунтовану фармакодинамічну класифікацію цієї групи психотропних препаратів. Використання цієї класифікації дозволяє значною мірою передбачити спектр психотропної активності, толерантність та ймовірні лікарські взаємодії конкретного препарату. Іншими словами, особливості нейрохімічної активності препарату значною мірою визначають особливості його клінічної активності, що слід використовувати при виборі конкретного антипсихотичного препарату для конкретного пацієнта.
Ефективність глобального антипсихотичного ефекту будь-якого нейролептика оцінюється за допомогою так званого хлорпромазинового еквівалента, який приймається за 1. Наприклад, хлорпромазиновий еквівалент галоперидолу = 50. Це означає, що антипсихотична ефективність 1 мг галоперидолу порівнянна з 50 мг хлорпромазину. На основі цього показника розроблено класифікацію, яка передбачає виділення нейролептиків з високою (хлорпромазиновий еквівалент > 10,0), середньою (хлорпромазиновий еквівалент = 1,0-10,0) та низькою (хлорпромазиновий еквівалент = 1,0) антипсихотичною активністю, що називається патентністю. Типові нейролептики (антипсихотики першого покоління) широко використовуються в клінічній психофармакотерапії вже майже півстоліття. Спектр їх терапевтичної активності включає:
- глобальна антипсихотична дія у вигляді здатності рівномірно та диференційовано зменшувати різні прояви психозу:
- первинний седативний (гальмівний) ефект – здатність препаратів швидко знімати психомоторне збудження;
- селективна, вибіркова антипсихотична дія, що проявляється у здатності впливати на окремі симптоми: марення, галюцинації, розгальмування потягів тощо;
- активуюча (дезінгібіторна, розгальмівна, антиаутистична) нейротропна дія, що проявляється розвитком екстрапірамідних симптомів;
- соматотропна дія у вигляді розвитку нейроендокринних та вегетативних побічних ефектів;
- депресивний ефект, що виражається у здатності деяких антипсихотичних препаратів викликати депресивні симптоми.
Ефективність антипсихотичних препаратів першого покоління в лікуванні не лише психотичних розладів, а й розладів у межах прикордонної психіатрії була багаторазово доведена та є безперечною. Тому, незважаючи на високу частоту побічних ефектів терапії при їх призначенні, вони продовжують використовуватися в медичній практиці.
Побічні ефекти антипсихотичної терапії
У таблиці наведено основні побічні ефекти атипової антипсихотичної терапії.
Підготовка |
Екстрапірамідні |
Порушення провідності на ЕКГ |
Порушення обміну речовин (збільшення ваги, підвищення рівня глюкози, холестерину, тригліцеридів у крові) |
||
Клозапін |
. |
++ |
++ |
++- |
|
Рисперидон |
++ |
+/- |
++ |
+/- |
|
Оланзапін |
+ |
+/- |
+++ |
++ |
+++ |
Кветіапін |
+/- |
+ |
+/- |
--- |
|
Зіпразидон |
+ |
++ |
+/- |
+/- |
+/- |
Сертиндол |
++ |
-- |
+/- |
-- |
|
Ариліпразол |
-- |
--- |
+/- |
-- |
-- |
Амісульприд |
++ |
+/- |
|||
Примітка. Ступінь тяжкості побічних ефектів: "+++" – висока; "++" – середня; "+" – низька; "+/-" – сумнівна; "-" – відсутня.
Екстрапірамідні синдроми
Однією з головних особливостей атипових антипсихотиків, на відміну від традиційних, є їхня низька здатність викликати екстрапірамідні синдроми, що стало проривом у підтримуючій фармакотерапії шизофренії. Однак, як випливає з даних таблиці, при застосуванні окремих препаратів цього ряду (рисперидон, амісульприд) можуть виникати такі симптоми, що вимагає особливої уваги при їх призначенні.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Аномалії ЕКГ
Можливість розвитку побічних ефектів з боку серця є серйозною проблемою при використанні деяких сучасних антипсихотичних препаратів у терапії. У цих випадках мова йде про подовження інтервалу QT, що може призвести до розвитку аритмії. Порушення провідності, насамперед подовження інтервалу QT, найчастіше спостерігаються під час лікування клозапіном, сертиндолом, зипразидоном. Супутня патологія у вигляді брадикардії, атріовентрикулярної блокади, гіпотиреозу може сприяти виникненню цього ускладнення під час терапії вищезгаданими препаратами. Наразі моніторинг ЕКГ рекомендується приблизно раз на 3 місяці у пацієнтів, які отримують підтримуючу терапію атиповими антипсихотичними препаратами.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Ендокринні розлади
Наразі найбільше занепокоєння викликає здатність атипових антипсихотичних препаратів спричиняти збільшення ваги. Підвищена маса тіла, рівень глюкози та тригліцеридів у крові може призвести до метаболічних порушень та розвитку діабету 2 типу. Особлива обережність та щотижневий моніторинг біохімічних показників необхідні під час терапії клозапіном та оланзапіном. На думку Дж. Геддеса та ін. (2000), П.Б. Джонса, П.Ф. Баклі (2006), слід визнати за доцільне проводити ретельне обстеження пацієнтів перед призначенням їм того чи іншого антипсихотичного препарату сучасного покоління, оскільки відомо, що метаболічні порушення частіше виникають у пацієнтів, які мали спадкову схильність, надмірну масу тіла, порушення ліпідного спектру та гіперглікемію до початку лікування. Алгоритм моніторингу, запропонований П.Б. Джонсом, П.Ф. Баклі (2006), включає кілька пунктів.
- Збір медичного анамнезу та сімейних факторів щодо ризику метаболічних порушень.
- Реєстрація індексу маси тіла, ЕКГ, артеріального тиску та пульсу перед початком лікування.
- Збір лабораторних даних (глюкоза, ліпідний профіль, холестерин) перед початком терапії.
- Регулярний моніторинг індексу маси тіла та життєво важливих показників під час лікування.
- Моніторинг лабораторних даних під час лікування.
Виникнення гіперпролактинемії під час антипсихотичної терапії зумовлене центральною блокадою дофамінових рецепторів у гіпоталамусі, що призводить до вивільнення пролактину з передньої долі гіпофіза. Гіперпролактинемія найчастіше виникає при лікуванні оланзапіном, рисперидоном та амісульпридом.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Агранулоцитоз
Ще одне серйозне ускладнення антипсихотичної терапії. Його можна спостерігати під час лікування клозапіном та оланзапіном. За даними J. Geddes et al. (2000), воно діагностувалося протягом перших 3 місяців у 1-2% пацієнтів, які приймали ці препарати. У зв'язку з цим пацієнтам, які приймають ці препарати, протягом перших 18 тижнів терапії рекомендуються щотижневі аналізи крові та щомісячний моніторинг після цього. Було показано, що при зменшенні дози вищезгаданих нейролептиків клінічний аналіз крові повертається до норми. Водночас слід визнати, що на сьогоднішній день немає чіткої стратегії для пацієнтів, які відчувають вищезгадані побічні ефекти, пов'язані з порушеннями обміну речовин. Найчастіше один атиповий антипсихотик замінюють іншим. Ще одним перспективним напрямком є призначення спеціальної коригувальної терапії, зокрема використання бромокриптину для корекції гіперпролактинемії. Ідеальною ситуацією є та, за якої догляд за пацієнтом з такими порушеннями здійснюється з періодичним залученням терапевтів, зокрема ендокринологів, кардіологів та інших спеціалістів.
На завершення слід зазначити, що за умови дотримання заданих алгоритмів призначення та моніторингу не лише психічного, а й фізичного стану пацієнтів, використання препаратів другого покоління є безпечнішим за типові нейролептики.
Низка інших антипсихотичних препаратів зараз перебуває на стадії розробки. Препарати наступного покоління, ймовірно, матимуть інший механізм дії (наприклад, ГАМКергічний профіль) і зможуть впливати на різні прояви шизофренії, включаючи власне дефіцитні розлади.
Атипові антипсихотичні засоби
Сучасні рекомендації містять дані про переваги використання антипсихотиків другого покоління у фармакотерапії. Термін «атиповий» (синонім – антипсихотики другого покоління) є умовним і використовується переважно для зручності позначення нового покоління. Порівняно з традиційними нейролептиками, препарати цієї групи ефективніше коригують негативні, афективні та когнітивні розлади, що поєднується з кращою переносимістю та меншим ризиком екстрапірамідних симптомів. Відмінності в характері терапевтичної дії того чи іншого препарату з ряду атипових антипсихотиків пояснюються, як і в групі типових нейролептиків, його індивідуальним профілем фармакологічної дії.
Для уточнення можливостей психофармакотерапії атиповими антипсихотиками доцільно зосередитися на препаратах цієї групи, зареєстрованих у Росії.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Клозапін (дибензодіазепін)
Засновник групи атипових антипсихотиків. Механізм дії клозапіну характеризується незначною блокадою D2-рецепторів з одночасним високим антагонізмом до 5-HT2a-рецепторів, a1-, a2-адренергічних та H1-гістамінових рецепторів. Він зарекомендував себе як ефективний антипсихотик у випадках резистентності до інших антипсихотиків (препарат резервної групи), а також показаний для лікування хронічної манії, психотичного збудження, агресії. У вітчизняній практиці клозапін часто призначають для досягнення седації та як снодійний засіб у психотичних пацієнтів. Слід визнати, що таке використання клозапіну не відповідає його основному профілю показань до застосування в терапії. Ймовірно, ставлення до цього антипсихотика як до препарату другорядного значення має бути переглянуте, оскільки сьогодні це єдиний препарат з доведеною ефективністю у резистентних пацієнтів.
Клозапін, на відміну від типових нейролептиків, не викликає серйозних екстрапірамідних розладів через вищезгадану низьку спорідненість до О2-рецепторів. Також виявилося, що його можна використовувати для лікування пізньої дистонії та тяжкої акатизії. Через низький ризик розвитку ЗНС, клозапін можна вважати препаратом вибору у пацієнтів, які раніше страждали на це ускладнення.
Однак під час терапії клозапіном може розвинутися низка серйозних побічних ефектів. Найнебезпечнішим з них (навіть при призначенні невеликих доз) є агранулоцитоз, який виникає у 0,5-1,0% пацієнтів. Інші важливі побічні ефекти, що можуть виникнути при застосуванні препарату, включають сонливість, гіперсалівацію та збільшення ваги, яка часто вже підвищена на момент призначення клозапіну під впливом попередньої антипсихотичної терапії. Слід також звернути увагу на можливість розвитку тахікардії, артеріальної гіпотензії та епілептичних нападів під час його прийому. Ймовірність виникнення нападів залежить від дози. Їх ризик значно зростає, якщо доза клозапіну перевищує 600 мг/добу. Розвиток нападів не є протипоказанням для подальшого застосування препарату, але вимагає зменшення дози вдвічі та призначення протисудомних препаратів, таких як вальпроєва кислота. Профілактика побічних ефектів лікування клозапіном включає ретельний моніторинг кількості лейкоцитів, а також ЕКГ та ендокринних показників.
Передозування клозапіну може спричинити пригнічення свідомості аж до розвитку коми, а також симптоми, пов'язані з холінолітичною дією (тахікардія, делірій), епілептичні напади, пригнічення дихання, екстрапірамідні синдроми. Летальний результат може настати при прийомі дози, що перевищує 2500 мг препарату.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Рисперидон
Похідне бензізоксазолу з високою спорідненістю до серотонінових та дофамінових Dj-рецепторів з переважним впливом на серотонінову систему. Препарат має широкий спектр показань до застосування, включаючи купірування загострень, протирецидивне лікування, терапію першого психотичного епізоду та корекцію негативних симптомів шизофренії. Було показано, що препарат покращує когнітивні функції у пацієнтів із шизофренією. Отримано попередні дані, що рисперидон також зменшує коморбідні афективні симптоми у пацієнтів із шизофренією та може бути препаратом вибору при лікуванні біполярних афективних розладів.
Побічні ефекти терапії рисперидоном, особливо екстрапірамідні розлади, залежать від дози та частіше виникають у дозах, що перевищують 6 мг/добу. Інші побічні ефекти включають нудоту, блювання, тривогу, сонливість та підвищення рівня пролактину в сироватці крові. Тривале застосування рисперидону може призвести до збільшення ваги та розвитку цукрового діабету 2 типу, але з меншою ймовірністю порівняно з клозапіном, оланзапіном.
Передозування може спричинити сонливість, епілептичні напади, подовження інтервалу QT та розширення комплексу QRS, а також артеріальну гіпотензію. Описано випадки летального результату внаслідок передозування рисперидоном.
Безсумнівною перевагою препарату є наявність рідкої та швидкорозчинної (сублінгвальної) форм, використання яких прискорює надходження препарату в організм пацієнта та полегшує контроль за його прийомом. Існує також пролонгована форма препарату – порошок для приготування суспензії для внутрішньом’язового введення (конста-рисперидон у мікросферах). Рекомендується для підтримуючого лікування пацієнтів із шизофренією, особливо для пацієнтів з поганою комплаєнсністю. Необхідно враховувати той факт, що препарату потрібно близько трьох тижнів для потрапляння в кров, тому, починаючи терапію конста-рисперидоном, пацієнт повинен додатково приймати пероральну форму рисперидону протягом щонайменше 3 тижнів після першої ін’єкції.
Оланзапін
За фармакологічною дією близький до клозапіну, оскільки має плейоморфний рецепторний профіль зі значною спорідненістю до серотонінових, мускаринових, α1-адренергічних та гістамінових рецепторів. Терапевтична активність оланзапіну має риси, подібні до ефективності клозапіну та рисперидону щодо впливу на позитивні, негативні та депресивні симптоми шизофренії. Водночас отримані дані про більшу ефективність оланзапіну порівняно з іншими атиповими антипсихотиками у пацієнтів з першим психотичним епізодом та в корекції показників когнітивного функціонування. Слід враховувати, що на початку терапії з використанням таблетованої форми препарату може проявлятися швидкий розгальмівний ефект з підвищеним психомоторним збудженням та тривогою. Тому при лікуванні нападів, що супроводжуються вираженим психомоторним збудженням, показано використання ін'єкційної форми препарату.
Оланзапін рідко викликає екстрапірамідні розлади або тардивну дискінезію, а найпоширенішими побічними ефектами при його застосуванні є порушення обміну речовин та збільшення ваги. Встановлено, що у пацієнтів, які отримують оланзапін, досить часто спостерігається підвищений рівень холестерину, ліпідів плазми та схильність до цукрового діабету 2 типу, але такі ефекти були однаково поширеними у пацієнтів, які отримували як оланзапін, так і клозапін. Водночас отримані дані, які показують, що збільшення ваги корелює з позитивною відповіддю на оланзапін (тобто служить важливим прогностичним показником терапії), а ожиріння розвивається лише у 20-30% пацієнтів, які набрали надлишкову вагу під час лікування.
Передозування може спричинити седативний ефект, токсичні антихолінергічні ефекти, епілептичні напади та артеріальну гіпотензію. Наразі немає переконливих даних для оцінки ризику смерті від передозування.
Кветіапін
Він класифікується як дибензотіазепінова сполука. Його рецепторний профіль значною мірою подібний до профілю клозапіну. Рівень зв'язування кветіапіну з D2-рецепторами низький (менше 50%) і короткочасний навіть при застосуванні високих доз. Препарат ефективний у лікуванні позитивних, негативних та загальних симптомів шизофренії. Є дані про його успішне застосування як у випадках високої резистентності до терапії, так і для покращення когнітивного функціонування пацієнтів, що дає право рекомендувати його як антипсихотичний засіб першої лінії для підтримуючої терапії шизофренії. Нарешті, кветіапін має помірний антидепресивний, активуючий ефект. Тому він показаний при лікуванні депресивно-маячних нападів та розладів сенесто-іпохондричного кола.
Встановлена висока тимотропна активність кветіапіну пояснює той факт, що він зареєстрований як засіб для полегшення та вторинної профілактики депресивних розладів. Для лікування маніакальних епізодів у рамках біполярних розладів I та II типу кветіапін використовується як додатковий засіб. Відсутність ін'єкційних форм дещо обмежує його застосування у пацієнтів зі збудженням та агресивною поведінкою.
Кветіапін добре переноситься, практично не викликає екстрапірамідних синдромів, за винятком випадків, коли застосовуються максимальні дози. Кветіапін не викликає гіперпролактинемії, рідше, ніж оланзапін та клозапін, призводить до збільшення ваги та порушення толерантності до глюкози.
Зіпразидон
Має унікальний профіль рецепторної активності. Будучи потужним антагоністом 5HT2a-рецепторів та D2-рецепторів, він також є активним інгібітором зворотного захоплення серотоніну та норадреналіну. Клінічні дослідження продемонстрували значну перевагу зипразидону в його впливі на психотичні симптоми та прояви агресії порівняно з галоперидолом. Також є дані про позитивний вплив зипразидону на когнітивні функції пацієнтів із шизофренією, а також на коморбідні афективні симптоми, показники соціального функціонування. Зипразидон зазвичай добре переноситься і дуже рідко викликає екстрапірамідні синдроми, збільшення ваги та метаболічні порушення. Частіше спостерігається подовження інтервалу QT понад 460 мс, тому пацієнтам, які отримують цей препарат, доцільно пройти ЕКГ-дослідження як перед призначенням препарату, так і контрольний моніторинг під час лікування. Особливу увагу слід приділяти супутній терапії (прийому антиаритмічних препаратів), яка може посилити подовження інтервалу QT та призвести до розвитку серцевої аритмії, фібриляції шлуночків.
Сертиндол
Належить до похідних феніліндолу. Має високий функціональний антагонізм щодо D2-, серотонінових (особливо 5-HT2a-рецепторів) та a1-адренергічних рецепторів. Згідно з електронейрохімічними дослідженнями, сертиндол селективно пригнічує дофамінові рецептори у вентральній сегментарній ділянці. Така селективність, найімовірніше, забезпечує низький ризик розвитку екстрапірамідних синдромів та гіперпролактинемії при застосуванні препарату. Результати порівняльних досліджень показали, що сертиндол за антипсихотичною активністю можна порівняти з галоперидолом. Препарат має виражену дезінгібіторну дію у пацієнтів з негативними та депресивними симптомами, яка перевершує аналогічну дію рисполепту. Також є дані, що підтверджують ефективність сертиндолу для корекції когнітивних порушень у пацієнтів із шизофренією. Сертиндол загалом добре переноситься пацієнтами, рідко викликає седативний ефект і тому рекомендується як замісний препарат при виникненні побічних ефектів під час терапії іншими сучасними антипсихотиками.
До серйозних побічних ефектів належить здатність препарату подовжувати інтервал QT, що може призвести до серцевої аритмії. Під час аналізу постмаркетингових досліджень стало зрозуміло, що серцевий профіль сертиндолу не відрізняється від профілю інших антипсихотичних препаратів нового покоління.
Арипіпразол
Він має антипсихотичну активність, порівнянну з іншими атиповими засобами, але має більший вплив на параметри когнітивного функціонування пацієнтів із шизофренією. Вищезгадана унікальна фармакологічна дія препарату – частковий агоніст D2-рецепторів – дозволяє знизити ризик екстрапірамідних синдромів та гіперпролактинемії при його застосуванні.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Амісульприд
Належить до класу заміщених бензамідів. Препарат вибірково зв'язується з підтипами D2 та D3 дофамінергічних рецепторів, не має спорідненості до підтипів D1, D4 та D5, а також до серотонінових, H1-гістамінових, a1-адренергічних та холінергічних рецепторів. При застосуванні у високих дозах блокує постсинаптичні D2-рецептори. У низьких дозах його дезінгібуючий ефект проявляється завдяки блокаді пресинаптичних D2-, D3-рецепторів, завдяки чому його застосування також ефективне при лікуванні негативної симптоматики, хоча він не є комбінованим антагоністом D2-рецепторів та серотонінових рецепторів. Результати низки досліджень свідчать про виражену антипсихотичну активність препарату при застосуванні у високих дозах, яка перевершує традиційні препарати.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
