Медичний експерт статті
Нові публікації
Причини та патогенез дифтерії
Останній перегляд: 04.07.2025

Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Дифтерія є парадигмою токсигенних інфекційних захворювань. У 1883 році Клебс довів, що збудником дифтерії є Corynebacterium diphtheriae. Через рік Леффлер виявив, що організм можна культивувати лише з носоглоткової порожнини, і припустив, що пошкодження внутрішніх органів спричинене розчинним токсином. До 1888 року Ру та Єрсен показали, що у тварин, яким вводили стерильні фільтрати C. diphtheriae, розвивалася патологія органів, невідрізна від такої при дифтерії у людей; це продемонструвало, що потужний екзотоксин був основним фактором вірулентності.
Дифтерія найчастіше є інфекцією верхніх дихальних шляхів, що викликає лихоманку, біль у горлі та нездужання. Товста, сіро-зелена фібринова мембрана, псевдомембрана, часто утворюється в місці (місцях) інфекції в результаті комбінованого впливу росту бактерій, вироблення токсинів, некрозу тканин та імунної відповіді хазяїна. Визнання того, що системне ураження органів зумовлене дією дифтерійного токсину, призвело до розробки як ефективної терапії на основі антитоксинів для лікування гострої інфекції, так і високоефективної анатоксинової вакцини.
Хоча імунізація анатоксином зробила дифтерію рідкісним захворюванням у районах, де стандарти охорони здоров'я вимагають вакцинації, спалахи дифтерії все ще трапляються в невакцинованих та імунокомпрометованих групах. Натомість, у районах, де програми активної імунізації були призупинені, спостерігалися широкомасштабні спалахи дифтерії, що досягли епідемічних масштабів.
Інші види коринебактерій
Окрім C. diphtheriae, C. ulcerans та C. pseudotuberculosis, C. pseudodiphtheriticum та C. xerosis можуть іноді спричиняти інфекції носоглотки та шкіри. Два останні штами розпізнаються за їхньою здатністю виробляти піразинамідазу. У ветеринарній медицині C. renale та C. kutscheri є важливими патогенами, що викликають пієлонефрит у великої рогатої худоби та латентні інфекції у мишей відповідно.
Причини
Збудник дифтерії, Corynebacterium diphtheriae, являє собою тонку, злегка вигнуту паличку з булавоподібними потовщеннями на кінцях, нерухому; вона не утворює спор, капсул або джгутиків, є грампозитивною.
Окрім токсину, коринебактерії дифтерії під час своєї життєдіяльності виробляють нейрамінідазу, гіалуронідазу, гемолізин, некротизуючий та дифузний фактори, які можуть спричиняти некроз та розрідження основної речовини сполучної тканини.
Залежно від здатності утворювати токсини, коринебактерії дифтерії поділяються на токсигенні та нетоксигенні.
Дифтерійний токсин – це потужний бактеріальний екзотоксин, який визначає як загальні, так і місцеві клінічні прояви захворювання. Токсигенність є генетично зумовленою. Нетоксигенні коринебактерії дифтерії не викликають захворювання.
За культуральними та морфологічними ознаками всі коринебактерії дифтерії поділяються на 3 варіанти: gravis, mitis, intermedius. Прямої залежності тяжкості захворювання від варіанта коринебактерій дифтерії немає. Кожен варіант містить як токсигенні, так і нетоксигенні штами. Токсигенні коринебактерії всіх варіантів продукують ідентичний токсин. [ 1 ]
Структура, класифікація та типи антигенів
Corynebacterium diphtheriae – це грампозитивна, нерухома паличка булавоподібної форми. Штами, що ростуть у тканинах або старіші культури in vitro, містять дрібні цятки в клітинних стінках, які дозволяють знебарвлювати їх під час фарбування за Грамом і призводять до змінної реакції Грама. Старіші культури часто містять метахроматичні гранули (поліметафосфат), які забарвлюються в блакитно-фіолетовий колір метиленовим синім. Цукри клітинної стінки включають арабінозу, галактозу та манозу. Крім того, може бути виділений токсичний 6,6'-естер трегалози, що містить коринеміколеву та коринеміколенову кислоти в еквімолярних концентраціях. Розрізняють три різні типи культур: mitis, intermedius, gravis.
Більшості штамів для росту потрібні нікотинову та пантотенову кислоти; деяким також потрібні тіамін, біотин або пімелінова кислота. Для оптимального вироблення дифтерійного токсину середовище необхідно доповнити амінокислотами та відкласти.
Ще в 1887 році Леффлер описав виділення авірулентних (нетоксигенних) штамів C. diphtheriae, які неможливо було відрізнити від вірулентних (токсигенних) штамів, виділених від пацієнтів у здорових людей. Зараз визнано, що авірулентні штами C. diphtheriae можуть бути перетворені на вірулентний фенотип після інфікування та лізогенізації одним з ряду різних коринебактеріофагів, що несуть структурний ген дифтерійного токсину, tox. Лізогенне перетворення авірулентного на вірулентний фенотип може відбуватися як in situ, так і in vitro. Структурний ген дифтерійного токсину не є необхідним ні для коринебактеріофага, ні для C. diphtheriae. Незважаючи на це спостереження, генетичного дрейфу дифтерійного токсину не спостерігалося.
Патогенез
Вхідними точками інфекції є слизові оболонки ротоглотки, носа, гортані, рідше слизова оболонка очей та статевих органів, а також пошкоджена шкіра, ранові або опікові поверхні, попрілості, незагоєна пупкова ранка. У місці входу коринебактерія дифтерії розмножується та виділяє екзотоксин.
Ексудат, багатий фібриногеном, виділяється та перетворюється на фібрин під впливом тромбокінази, що виділяється під час некрозу епітеліальних клітин. Утворюється фібринозна плівка – характерна ознака дифтерії.
Безсимптомне носоглоткове носійство є поширеним явищем в ендемічних щодо дифтерії регіонах. У схильних до цього осіб токсигенні штами викликають захворювання шляхом реплікації та секретування дифтерійного токсину в носоглотці або шкірних ураженнях. Дифтерійне ураження часто покрите псевдомембраною, що складається з фібрину, бактерій та запальних клітин. Дифтерійний токсин може бути протеолітично розщеплений на два фрагменти: N-кінцевий фрагмент А (каталітичний домен) та фрагмент В (трансмембранний та рецептор-зв'язуючий домени). Фрагмент А каталізує NAD+-залежне АДФ-рибозилювання фактора елонгації 2, тим самим пригнічуючи синтез білка в еукаріотичних клітинах. Фрагмент В зв'язується з рецептором на поверхні клітини та сприяє доставці фрагмента А в цитозоль.
Захисний імунітет включає антитілну відповідь на дифтерійний токсин після клінічного захворювання або на дифтерійний токсин (токсин, інактивований формальдегідом) після імунізації.
Колонізація
Мало що відомо про фактори, що опосередковують колонізацію C. diphtheriae. Однак очевидно, що інші фактори, окрім вироблення дифтерійного токсину, сприяють вірулентності. Епідеміологічні дослідження показали, що певний лізотип може зберігатися в популяції протягом тривалого часу. Пізніше він може бути замінений іншим лізотипом. Поява та подальше домінування нового лізотипу в популяції, ймовірно, пов'язане з його здатністю колонізувати та ефективно конкурувати у своєму сегменті екологічної ніші носоглотки. Corynebacterium diphtheriae може виробляти нейрамінідазу, яка розщеплює сіалову кислоту клітинної поверхні на її компоненти: піруват та N-ацетилнейрамінову кислоту. Шнуровий фактор (6,6'-ді-O-міколоїл-α, α'-D-трегалоза) є поверхневим компонентом C. diphtheriae, але його роль у колонізації людини-хазяїна неясна.
Виробництво дифтерійних токсинів
Структурний ген дифтерійного токсину, tox, належить до родини близькоспоріднених коринебактеріофагів, з яких β-фаг є найкраще вивченим. Регуляція експресії дифтерійного токсину опосередковується залізо-активованим репресором DtxR, який кодується геномом C. diphtheriae. Експресія токсину залежить від фізіологічного стану C. diphtheriae. За умов, коли залізо стає субстратом, що лімітує швидкість росту, залізо дисоціює від DtxR, ген токсикодендрону активується, а дифтерійний токсин синтезується та секретується в культуральне середовище з максимальною швидкістю.
Дифтерійний токсин надзвичайно потужний; для чутливих видів (наприклад, людей, мавп, кроликів, морських свинок) навіть від 100 до 150 нг/кг маси тіла є смертельними. Дифтерійний токсин складається з одного поліпептидного ланцюга з 535 амінокислот. Біохімічний, генетичний та рентгеноструктурний аналіз показують, що токсин складається з трьох структурних/функціональних доменів:
- N-кінцева АДФ-рибозилтрансфераза (каталітичний домен);
- ділянка, що сприяє доставці каталітичного домену через клітинну мембрану (трансмембранний домен);
- домен зв'язування рецептора еукаріотичних клітин.
Після м'якого трипсиново-чутливого розщеплення та відновлення в денатуруючих умовах, дифтерійний токсин може бути специфічно розщеплений у своїй протеазочутливій петлі на два поліпептидні фрагменти (А та В). Фрагмент А є N-кінцевим компонентом токсину молекулярною масою 21 кДа та містить каталітичний сайт для АДФ-рибозилювання фактора елонгації 2 (EF-2).
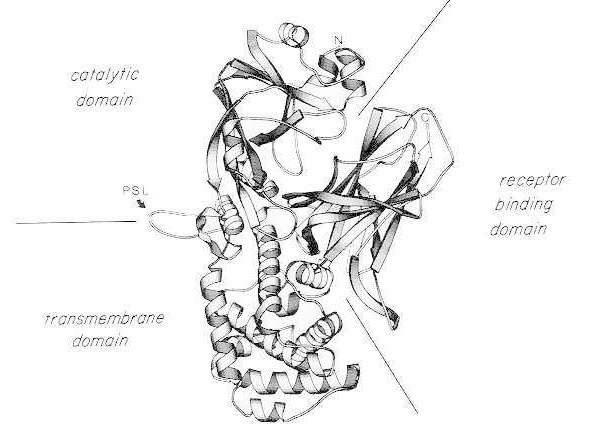
Стрічкова діаграма рентгенівської кристалічної структури мономерного нативного дифтерійного токсину. (модифіковано з Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Показано відносне розташування каталітичних, трансмембранних та рецептор-зв'язуючих доменів. Інтактний токсин може бути розщеплений трипсиноподібними протеазами в Arg190, Arg192 та/або Arg193, які розташовані в протеазочутливій петлі (PSL). Після відновлення дисульфідного містка між Cys186 та Cys201, токсин може бути розділений на фрагменти A та B. Показано N-кінець (N) та карбокси-кінець (C) інтактного токсину. Смужкова діаграма була створена за допомогою програми MOLESCRIPT.
С-кінцевий фрагмент, фрагмент B, містить трансмембранний та рецептор-зв'язуючий домени токсину.
Отруєння однієї еукаріотичної клітини дифтерійним токсином включає щонайменше чотири окремі етапи:
- зв'язування токсину з його рецептором на поверхні клітини;
- кластеризація заряджених рецепторів у покритих ямках та інтерналізація токсину через рецептор-опосередкований ендоцитоз; після підкислення ендоцитарного везикула мембраноасоційованим протонним насосом, керованим АТФ,
- вбудовування трансмембранного домену в мембрану та полегшення доставки каталітичного домену в цитозоль, та
- АДФ-рибозилювання EF-2, що призводить до незворотного пригнічення синтезу білка.
Було показано, що однієї молекули каталітичного домену, доставленої в цитозоль, достатньо, щоб бути летальною для клітини.
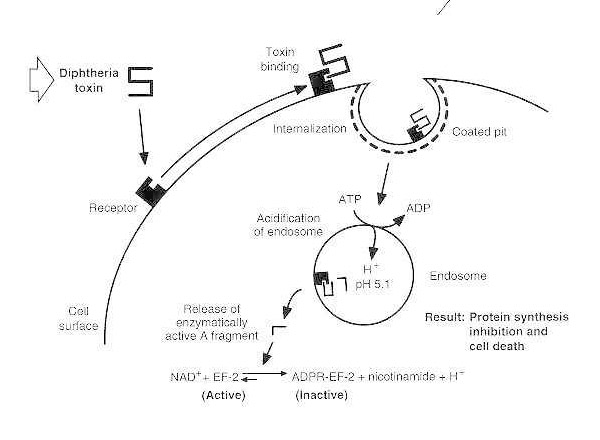
Схематична діаграма дифтерійної інтоксикації чутливої еукаріотичної клітини.
Токсин зв'язується з рецептором на поверхні клітини та інтерналізується через рецептор-опосередкований ендоцитоз; після підкислення ендосоми трансмембранний домен вставляється в мембрану везикули; каталітичний домен доставляється в цитозоль, що призводить до пригнічення синтезу білка та загибелі клітин.
Епідеміологія
До масової імунізації населення США дифтерійним анатоксином дифтерія зазвичай була дитячим захворюванням. Примітним аспектом масової імунізації дифтерійним анатоксином є те, що зі збільшенням відсотка населення із захисним рівнем антитоксичного імунітету (≥ 0,01 МО/мл) частота виділення токсигенних штамів з населення зменшується. Сьогодні в Сполучених Штатах, де клінічна дифтерія майже повністю зникла, виділення токсигенних штамів C. diphtheriae є рідкісним явищем. Оскільки субклінічна інфекція більше не є джерелом контакту з дифтерійним антигеном, і, якщо не підвищити імунітет до антитоксину, він зменшується, великий відсоток дорослих (від 30 до 60%) має рівень антитоксину нижче захисного рівня та перебуває в групі ризику. У Сполучених Штатах, Європі та Східній Європі нещодавні спалахи дифтерії сталися переважно серед осіб, які зловживають алкоголем та/або наркотиками. У цій групі носії токсигенного C. diphtheriae мають помірно високий рівень антитоксичного імунітету. Нещодавній провал заходів охорони здоров'я в Росії призвів до того, що дифтерія перетворилася на епідемію. До кінця 1994 року в Росії було зареєстровано понад 80 000 випадків захворювання та понад 2000 смертей.
Вогнищеві спалахи дифтерії майже завжди пов'язані з імуноносієм, який повернувся з регіону, де дифтерія є ендемічною. Дійсно, нещодавні спалахи клінічної дифтерії в Сполучених Штатах та Європі були пов'язані з мандрівниками, які поверталися з Росії та Східної Європи. Токсигенні штами C. diphtheriae передаються безпосередньо від людини до людини повітряно-крапельним шляхом. Відомо, що токсигенні штами можуть безпосередньо колонізувати носоглоткову порожнину. Крім того, токсигенний ген може поширюватися опосередковано шляхом вивільнення токсигенного коринебактеріофага та лізогенної трансформації нетоксигенного автохтонного C. diphtheriae in situ. [ 5 ]
Окрім визначення біотипу та лізотипу ізолятів C. diphtheriae, для вивчення спалахів дифтерії тепер можна використовувати методи молекулярної біології. Для вивчення клінічних спалахів використовувалися патерни рестрикційного ендонуклеазного перетравлення хромосомної ДНК C. diphtheriae, а також клоновані послідовності вставлення коринебактерій як генетичний зонд.
Тест Шика використовується вже багато років для оцінки імунітету до дифтерійного токсину, хоча зараз у багатьох регіонах його замінив серологічний тест на специфічні антитіла до дифтерійного токсину. У тесті Шика невелика кількість дифтерійного токсину (приблизно 0,8 нг у 0,2 мл) вводиться внутрішньошкірно в передпліччя (місце тестування), а 0,0124 мкг дифтерійного токсину в 0,2 мл вводиться внутрішньошкірно в контрольне місце. Показники визначають через 48 та 96 годин. Неспецифічні шкірні реакції зазвичай досягають піку через 48 годин. Через 96 годин еритематозна реакція з можливим некрозом у місці тестування вказує на недостатній антитоксичний імунітет для нейтралізації токсину (≤ 0,03 МО/мл). Запалення як у тестовій, так і в контрольній ділянках після 48 годин вказує на реакцію гіперчутливості до антигенного препарату.
Форми
Corynebacterium diphtheriae інфікує носоглотку або шкіру. Токсигенні штами виробляють потужний екзотоксин, який може спричинити дифтерію. Симптоми дифтерії включають фарингіт, лихоманку та набряк шиї або області навколо ураження шкіри. Дифтерійні ураження покриті псевдомембраною. Токсин поширюється кровотоком до віддалених органів і може спричинити параліч і застійну серцеву недостатність. [ 6 ]
Існує два типи клінічної дифтерії: носоглоткова та шкірна. Симптоми фарингеальної дифтерії варіюються від легкого фарингіту до гіпоксії через обструкцію дихальних шляхів псевдомембраною. Ураження шийних лімфатичних вузлів може спричинити сильний набряк шиї (дифтерія шиї бика), і у пацієнта може підвищитися температура (≥ 38°C). Ураження шкіри при шкірній дифтерії зазвичай покриті сіро-коричневою псевдомембраною. В результаті дії дифтерійного токсину на периферичні рухові нейрони та міокард можуть розвинутися системні ускладнення, що загрожують життю, головним чином втрата рухової функції (наприклад, утруднене ковтання) та застійна серцева недостатність.
КОНТРОЛЬ
Контроль дифтерії залежить від адекватної імунізації дифтерійним анатоксином: дифтерійний токсин інактивується формальдегідом, який залишається антигенно неушкодженим. Анатоксин готують шляхом інкубації дифтерійного токсину з формальдегідом при температурі 37°C у лужних умовах. Імунізацію проти дифтерії слід розпочинати на другому місяці життя із серії з трьох первинних доз з інтервалом від 4 до 8 тижнів, а потім четверту дозу приблизно через 1 рік після останньої первинної вакцинації. Дифтерійний анатоксин широко використовується як компонент вакцини проти дифтерії, кашлюку та правця (АКДС). Епідеміологічні дослідження показали, що імунізація проти дифтерії є приблизно на 97% ефективною. Хоча масова імунізація проти дифтерії практикується в Сполучених Штатах та Європі, а рівень імунізації дітей є достатнім, значна частина дорослого населення може мати титри антитіл нижче захисного рівня. Дорослих слід ревакцинувати дифтерійним анатоксином кожні 10 років. Дійсно, ревакцинацію дифтерійно-правцевим анатоксином слід проводити особам, які прямують до районів з високим рівнем ендемічної дифтерії (Центральна та Південна Америка, Африка, Азія, Росія та Східна Європа). В останні роки використання високоочищених препаратів анатоксину для імунізації мінімізувало епізодичні тяжкі реакції гіперчутливості. ревакцинацію дифтерійно-правцевим анатоксином слід проводити особам, які прямують до районів з високим рівнем ендемічної дифтерії (Центральна та Південна Америка, Африка, Азія, Росія та Східна Європа). В останні роки використання високоочищених препаратів анатоксину для імунізації мінімізувало епізодичні тяжкі реакції гіперчутливості. ревакцинацію дифтерійно-правцевим анатоксином слід проводити особам, які прямують до районів з високим рівнем ендемічної дифтерії (Центральна та Південна Америка, Африка, Азія, Росія та Східна Європа). В останні роки використання високоочищених препаратів анатоксину для імунізації мінімізувало епізодичні тяжкі реакції гіперчутливості.
Хоча антибіотики (такі як пеніцилін та еритроміцин) використовуються як частина лікування пацієнтів з дифтерією, швидка пасивна імунізація дифтерійним антитоксином є найефективнішою для зниження летальності. Тривалий період напіввиведення специфічного антитоксину в крові є важливим фактором для забезпечення ефективної нейтралізації дифтерійного токсину; однак, щоб бути ефективним, антитоксин повинен реагувати з токсином, перш ніж він зможе потрапити в клітину.
Реінжиніринг дифтерійного токсину для розробки цитотоксинів, специфічних до еукаріотичних рецепторів
Білкова інженерія – це нова та швидко розвиваюча галузь молекулярної біології; вона поєднує методології рекомбінантної ДНК та твердофазний синтез ДНК для проектування та конструювання химерних генів, продукти яких мають унікальні властивості. Дослідження структурно-функціональних зв'язків дифтерійного токсину чітко показали, що цей токсин є тридоменним білком: каталітичним, трансмембранним та рецепторним. Вдалося генетично замінити нативний рецептор-зв'язуючий домен дифтерійного токсину різними поліпептидними гормонами та цитокінами (наприклад, α-меланоцитстимулюючим гормоном [α-MSH], інтерлейкіном (IL) 2, IL-4, IL-6, IL-7, епідермальним фактором росту). Отримані химерні білки або токсини злиття поєднують специфічність зв'язування з рецептором цитокіну з трансмембранним та каталітичним доменами токсину. У кожному випадку було показано, що токсини злиття вибірково отруюють лише ті клітини, які несуть відповідний цільовий рецептор. Перший із цих генетично модифікованих фузійних токсинів, DAB 389IL-2, зараз проходить клінічні випробування на людях для лікування рефрактерних лімфом та аутоімунних захворювань, у яких клітини з високоафінними рецепторами IL-2 відіграють важливу роль у патогенезі.[ 7 ] Було показано, що введення DAB 389 IL-2 є безпечним, добре переноситься та здатним викликати стійку ремісію захворювання без серйозних побічних ефектів. Цілком ймовірно, що фузійні токсини на основі дифтерійного токсину стануть важливими новими біологічними агентами для лікування специфічних пухлин або захворювань, при яких можна впливати на специфічні рецептори клітинної поверхні.


 [
[